
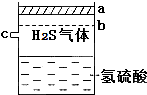
 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O3/Zn+H2O |
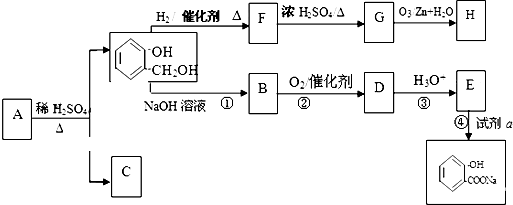
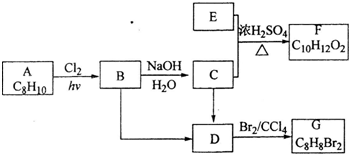
 与饱和溴水反应的化学方程式
与饱和溴水反应的化学方程式 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol/LHF溶液中pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油(水)--分液 |
| B、Fe(OH)3胶体(HCl)--渗析 |
| C、水(NaCl)--蒸馏 |
| D、CO2(HCl)--氢氧化钠溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去KNO3中的NaCl杂质----结晶.重结晶 |
| B、除去食盐中的泥沙-----过滤 |
| C、除去KCl中的K2CO3-----加适量盐酸 |
| D、除去碘水中的水-----升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A、Q2=98.5 kJ |
| B、2SO2(g)+O2(g)?2SO3(s);△H>-197KJ/mol |
| C、丙容器中压强大于乙,所以丙的反应速率大于乙 |
| D、2Q3<Q1<197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HR溶液的导电性较弱,HR属于弱酸 |
| B、某化合物溶于水导电,则该化合物为电解质 |
| C、根据电解质在其水溶液中能否完全电离,将电解质分为强电解质和弱电解质 |
| D、食盐是电解质,食盐的水溶液也是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com