
| V |
| Vm |
| 2.24L |
| 22.4L/mol |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
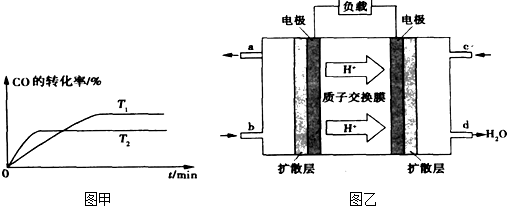
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业上用NH3、CO2在180 ℃、1.5×107—3×107 Pa条件下合成尿素( );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
(2)甲烷(CH4)在一定条件下跟水反应可生成水煤气(H2和CO),工业上用之作合成氨的原料气;CO和H2在一定条件下又可转化成CH4。
(3)在生物学上,CO2和H2O通过光合作用可合成葡萄糖(C6H12O6);葡萄糖在人体内通过生理氧化又可转化成CO2和H2O而放出热量,以供人体所需。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物和无机物之间是可以相互转化的,请写出下列转化的化学反应方程式。
(1)工业上用NH3、CO2在180 ℃、1.5×107—3×107 Pa条件下合成尿素( );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
(2)甲烷(CH4)在一定条件下跟水反应可生成水煤气(H2和CO),工业上用之作合成氨的原料气;CO和H2在一定条件下又可转化成CH4。
(3)在生物学上,CO2和H2O通过光合作用可合成葡萄糖(C6H12O6);葡萄糖在人体内通过生理氧化又可转化成CO2和H2O而放出热量,以供人体所需。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com