
【题目】用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )

A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自左向右移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为 B池为 。
(2)铜极为______极,电极反应式为 。
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为 。
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学生活与技术]
分析下列水处理方法,完成下列问题:
(1)处理含Cr2O72-工业废水的工艺:
①工艺一:含Cr2O72-的工业废水![]() Cr3+、SO42-
Cr3+、SO42-![]() 。
。
为了进一步除去上述流程中生成的Cr3+,请你设计一个处理方案:________________。
②工艺二:向废水中加入过量的FeSO4溶液,经过一系列反应后,FeSO4溶液和Cr2O72-可形成铁氧体沉淀,从而除去铬元素。若使含1mol Cr2O72-的废水中的Cr2O72-完全转化为一种化学式为Cr0.5Fe2.5O4的铁氧体(其中的铬元素为+3价),理论上需要绿矾(FeSO4·7H2O)的质量不少于
g,上述得到的铁氧体中,Fe3+和Fe2+的个数之比 。
(2)如下是处理含氰(主要以CN—形式存在)废水工艺流程的一部分:
含氰废水![]() 。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为-1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为-1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
(3)监测水中氯化物含量可采用硝酸汞滴定法,酸化的水样用硝酸汞滴定时可生成难电离的氯化汞,滴定到终点时过量的汞离子可与指示剂作用使溶液显示紫色。饮用水中的其他物质在通常浓度下对滴定不产生干扰,但水的色质、高价铁、六价铬、硫化物(如S2-)对实验有干扰。
①滴定前常用氢氧化铝悬浊液处理水样,其目的是__________________。
②若水中含有Cr2O72—,常在滴定前向水样中加入一定量的对苯二酚,其目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:

(1)氧化铁黄中铁元素的化合价为 ,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是 (写离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是 。
(3)上述流程中,检验“洗涤”是否完全的方法是 。
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是 。
(5)取1g样品进行纯度测试,将其溶解于足量稀盐酸中,后用一定浓度的过量NaOH溶液沉淀其中的铁元素,得到沉淀的质量为Bg,试用所给数据求出产品的纯度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,
它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素,C是当今产量和用量最多的金属。请回答下列问题:
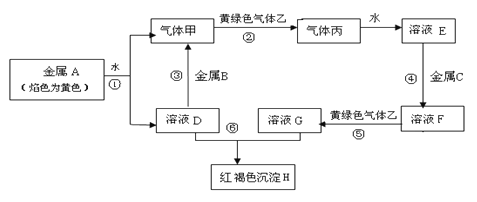
(1)写出金属B和气体丙的化学式 、 。
(2)写出反应①的化学反应方程式 。
(3)沉淀H的化学式为 。
(4)往溶液G中滴入KSCN溶液,现象是——————————————————
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A→F有如下转化关系:

已知:①
②核磁共振氢谱显示C的分子中含有4种不同化学环境的氢原子,且峰面积之比为3:2:2:1。
③F是酯类化合物,分子中苯环上的一溴代物只有两种。
(1)A的分子式是 ,主要用途是 (写一种)。
(2)检验B中官能团的常用方法是 。
(3)D物质的名称为 。
(4)C+E→F的化学方程式是 。
(5)X与E互为同分异构体,且X有下列性质,符合条件的X有 种。
①接触NaHCO3有二氧化碳气体产生。
②与银氨溶液共热有银镜现象。
③1摩尔X与足量钠反应有1摩尔气体产生。
(6)Y与E也互为同分异构体,属于酯类化合物,分子中只含一种官能团,且苯环上的一硝基取代物只有一种,则Y的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2A)按下式发生一级电离、二级电离:
H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-
H++A2-
已知相同浓度时,H2A比HA-电离程度大。设有下列四种溶液:
A.0.01mol·L-1 H2A溶液;
B.0.01mol·L-1 NaHA溶液;
C.0.02mol·L-1 HCl与0.04mol·L-1的NaHA溶液等体积混合;
D.0.02mol·L-1 NaOH溶液与0.02mol·L-1 NaHA溶液等体积混合,据此填写下列空白:
(1)c(H+)最大的是__________,最小的是__________。
(2)c(H2A)最大的是__________,最小的是__________。
(3)c(A2-)最大的是__________,最小的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫以及铁的化合物。
Ⅰ.近年来,湿法炼铜有了新进展,某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产铜和绿矾的工艺流程如下:

(1)试剂a为________,试剂b为_______(写名称)。
(2)反应1的化学方程式为 。
Ⅱ.以CuFeS2精矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O。沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图。

(3)沸腾炉生成物中的含铁物质主要成分为___________。
(4)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在______ ℃左右,高于该温度生成物中的水溶性Cu(%)下降,可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等。回答下列问题:
(1)A、B和C分别为__________、____________、_____________(用元素名称表示)。
(2)由以上元素组成的化合物中,属于离子化合物的是___________,属于共价化合物的是_________。(各写一种即可)
(3)B的常见气态氢化物的电子式为_______________,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有____________(填化学键的种类),该离子氯化物的水溶液呈__________性,用离子方程式表示为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com