
下列有关葡萄糖的叙述中,错误的是( )
A.能加氢生成六元醇
B.能发生银镜反应
C.能与醇发生酯化反应
D.能被氧化为CO2和H2O
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在800 K时,反应:CO(g)+H2O(g)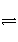
 H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X
B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
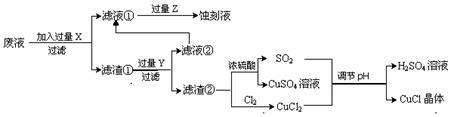
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
|
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是_____________________。
(2)写出生产过程中X:____ ______ Y:_____ _____ (填化学式)。
(3)写出产生CuCl的化学方程式:_________________________________________。
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是:______________________________。
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
________________________________ _____。
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于某病人尿糖检验的做法正确的是( )
A.取尿样,加入新制Cu(OH)2悬浊液,观察发生的现象
B.取尿样,加H2SO4中和碱性,再加入新制Cu(OH)2悬浊液,观察发生的现象
C.取尿样,加入新制Cu(OH)2悬浊液,煮沸,观察发生的现象
D.取尿样,加入Cu(OH)2悬浊液,煮沸,观察发生的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组顺序排列正确的是
A.密度:Na > K > Li B.热稳定性:HCl > H2S > H2O
C.酸性:H2CO3 < H2SiO3 < HNO3 D.离子半径:F -> A13+ > CI –
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是( )

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积(1)①4,6,6三甲基1,4庚二烯
②3甲基2乙基1丁烯
③1,2,4三甲基6乙苯

某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在同温同压下测定),0.1 mol该烃完全燃烧的产物全部被碱石灰吸收,碱石灰增重51.4 g。试解答:
(1)求该烃的分子式;
(2)若该烃的一氯代物只有一种,试写出该烃的结构简式并用系统命名法命名。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com