
【题目】CO2的综合利用对温室气体的减排以及对减缓燃料危机等具有重要意义。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
该催化重整反应的ΔH=____kJ·mol-1。
(2)CH4-CO2催化重整反应通过热力学计算可得到的图像之一如图。
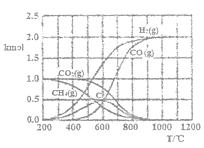
①200—400℃时,主要发生的反应的化学方程式为___。
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是__(用文字表达)。
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
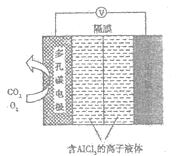
电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2。
+6O2。
反应过程中O2的作用是___。电池的负极反应式为___。
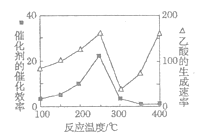
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。
①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为___。
②300~400℃时,乙酸的生成速率升高的原因是____。
【答案】+247 CH4![]() C+2H2 600℃以上,C与CO2反应生成CO 催化作用 Al-3e-=Al3+ 3Cu2Al2O4+32H++2NO
C+2H2 600℃以上,C与CO2反应生成CO 催化作用 Al-3e-=Al3+ 3Cu2Al2O4+32H++2NO![]() =6Cu2++6Al3++2NO↑+26H2O 300℃~400℃催化剂几乎失去催化效率,温度升高加快化学反应速率
=6Cu2++6Al3++2NO↑+26H2O 300℃~400℃催化剂几乎失去催化效率,温度升高加快化学反应速率
【解析】
(1)已知:①C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
③C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
根据盖斯定律③×2-②-①即得到该催化重整反应的ΔH=+247kJ·mol-1。
(2)①根据图像可知200~400℃时甲烷分解生成氢气和碳,主要发生的反应的化学方程式为CH4![]() C+2H2。
C+2H2。
②由于600℃以上,C与CO2反应生成CO,所以当温度高于600℃时,随着温度的升高C的物质的量减少。
(3)由于电池的正极反应式为:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2,这说明反应前消耗氧气,最后又产生氧气,则反应过程中O2的作用是催化作用。负极铝失去电子,则电池的负极反应式为Al-3e-=Al3+;
+6O2,这说明反应前消耗氧气,最后又产生氧气,则反应过程中O2的作用是催化作用。负极铝失去电子,则电池的负极反应式为Al-3e-=Al3+;
(4)①Cu2Al2O4可溶于稀硝酸生成硝酸铜、硝酸铝、一氧化氮和水,该反应的离子方程式为3Cu2Al2O4+32H++2NO![]() =6Cu2++6Al3++2NO↑+26H2O。
=6Cu2++6Al3++2NO↑+26H2O。
②根据图像可知300℃~400℃时催化剂几乎失去催化效率,温度升高加快化学反应速率,所以300~400℃时,乙酸的生成速率升高。


科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向偏铝酸钠溶液中通入过量的CO2:2AlO![]() +CO2+3H2O=2Al(OH)3↓+CO
+CO2+3H2O=2Al(OH)3↓+CO![]()
B.向HNO2溶液中滴加酸性KMnO4溶液:5NO![]() +2MnO
+2MnO![]() +3H2O=5NO
+3H2O=5NO![]() +2Mn2++3OH-
+2Mn2++3OH-
C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH![]() +H++SO
+H++SO![]() =BaSO4↓+NH3H2O+H2O
=BaSO4↓+NH3H2O+H2O
D.向银氨溶液中滴加乙醛溶液并水浴加热:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH
CH3COO-+NH![]() +2Ag↓+H2O+3NH3
+2Ag↓+H2O+3NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是

A.该反应的正反应为吸热反应
B.三个容器的容积:①>②>③
C.在P点,CO的转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时υ正(CO)<υ逆(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0mL 5.0 molL-1 H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。下列说法正确的是
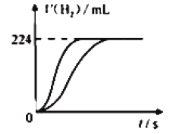
A.稀释后H2SO4溶液的物质的量浓度为0.04 molL-1
B.加入Fe的质量至少有0.56 g
C.反应过程中铁粉过量
D.金属Zn与硫酸反应转移电子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
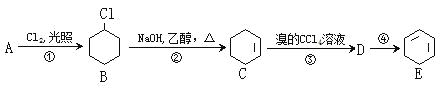
(1)A的名称是_____。
(2)填写以下反应的反应类型:①_____;④_____。
(3)物质C中含有的官能团的名称是_____。
(4)反应②的化学方程式为_____,反应③的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com