
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法错误的是 )。
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1) | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1) | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=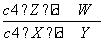
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr+H2O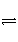
 Ur-+H3O+,
Ur-+H3O+,
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq)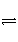
 NaUr(s)。下列对反应②的叙述正确的是( )
NaUr(s)。下列对反应②的叙述正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.升高温度,平衡向正反应方向移动
D.降低温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.胆矾是电解质、液氨是非电解质
B.淀粉溶液、硅酸、氯化铁溶液均为胶体
C.淀粉、纤维素、油脂都属于天然高分子化合物
D.SO3、SiO2、NO2均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
①透明溶液中:K+、Fe3+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、Br-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ca2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、Cl-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列有关电解质溶液的叙述正确的是 ( )
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应4A+2B3C,下列说法中正确的是 )。
A.某温度时,化学反应速率无论用A、B、C中任何物质表示,其数值都相同
B.其他条件不变时,降低温度,化学反应速率减小
C.其他条件不变时,增大压强,化学反应速率一定加快
D.若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列两组热化学方程式中,有关ΔH的比较正确的是 )。
①CH4g)+2O2g)===CO2g)+2H2Og) ΔH1
CH4g)+2O2g)===CO2g)+2H2Ol) ΔH2
②NaOHaq)+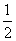 H2SO4浓)===
H2SO4浓)===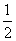 Na2SO4aq)+H2Ol) ΔH3
Na2SO4aq)+H2Ol) ΔH3
NaOHaq)+CH3COOHaq)===CH3COONaaq)+H2Ol) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4
B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4
D.ΔH1<ΔH2;ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
我国目前正在建造新型航母,已知航空母舰的主体是钢铁,如何减弱舰体的腐蚀成为急需攻克的一个课题,某同学设计如图实验,请根据铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中被腐蚀的快慢,判断在母舰舰体上最好嵌上的固体应为
( )。
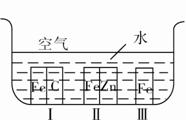
A.碳 B.锌 C.铁 D.铜
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应概念正误判断,正确的打“√”,错误的打“×”
(1)有化合价升降的化学反应一定是氧化还原反应( )
(2)置换反应全部属于氧化还原反应,因为有单质参加和生成,化合价发生了变化( )
(3)氧化还原反应一定属于四大基本反应类型( )
(4)有单质参加或生成的化学反应一定是氧化还原反应( )
(5)氧化还原反应中,反应物不是氧化剂就是还原剂( )
(6)在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质( )
(7)在氧化还原反应中,非金属单质都做氧化剂( )
(8)生成物中来源于氧化剂的是还原产物( )
(9)还原剂具有还原性,反应时本身被还原,发生还原反应( )
(10)元素从化合态变为游离态,该元素不一定被还原( )
(11)失电子越多,还原性越强,得电子越多,氧化性越强( )
(12)在同一氧化还原反应中,氧化剂的氧化性一定大于氧化产物的氧化性( )
(13)金属元素被还原,不一定得到金属单质( )
(14)含氧酸的价态越高,氧化性一定越强( )
(15)不容易得到电子的物质,肯定容易失去电子( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com