
、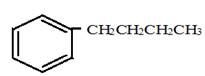 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)
的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)
A.6种 B.5种 C.4种 D.3种
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:实验题
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。

(1)在组装好装置后,若要检验A—E装置的气密性,其操作是首先 ,然后微热A,???察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好。
(2)装置B中盛放试剂是 。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生 (答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式 。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是 (用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式 。迅速产生倒吸的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:简答题
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
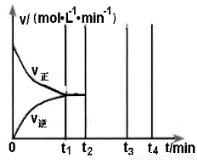
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆 )
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
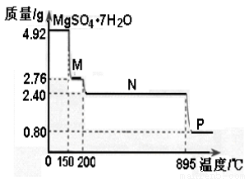
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:简答题
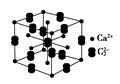
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示
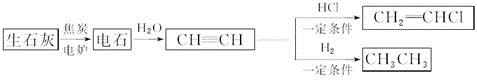
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
【有机物化学基础】
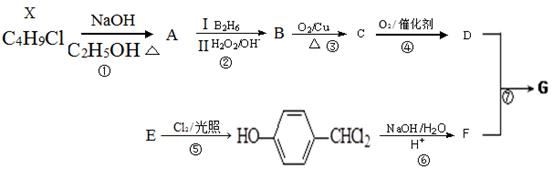
有机物G是制备液晶材料的中间体之一,其结构简式为:
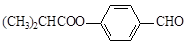
G的一种合成路线如下:其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2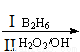 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是 ;C中官能团的名称是 。
(2)B的名称是 。第①~⑦步中属于取代反应的有 (填步骤编号)
(3)写出反应⑤的化学方程式 。
(4)第⑦步反应的化学方程式是 。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式 。
a.苯环上的一氯代物有2种; b.水解生成二元羧酸和醇。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列各图与表述不一致的是
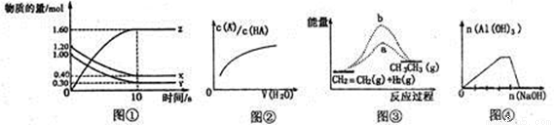
A. 图①表示T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线。若T℃时,若起始时X为1.20mol,Y为1.00mol,则平衡时Y的转化率为80%
B. 图②中曲线表示向弱酸HA的稀溶液中加水稀释
C. 图③b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g) △H<0,使用催化剂时,反应过程中的能量变化
D. 图④表示向NH4Al(SO4)2溶液中滴加过量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
其他条件不变时,下列措施不能使NO2转化率提高的是

 A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2 O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
有关电解质溶液的叙述,下列说法中正确的是
A.0.2 mol·L-1氨水中,c(OH-)与c(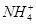 )相等
)相等
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),
原子核内质子数为(2n2一1)。下列关于元素X的说法中,不正确的是( )
A.其最高化合价一定为+5 B.可以形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com