
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
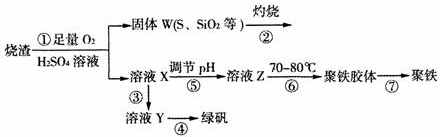
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| D. | 二氯甲烷存在两种不同的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
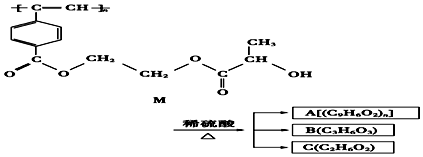
| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 | |
| C. | 1molM与热的烧碱溶液反应,可消耗2nmol的NaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| B. | 制蒸馏水时,应使温度计水银球雄近蒸馆烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com