
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
科目:高中化学 来源: 题型:
【题目】等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为
A.1:2:3 B.1:6:9 C.1:3:3 D.1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。
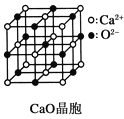
(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
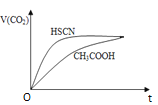
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
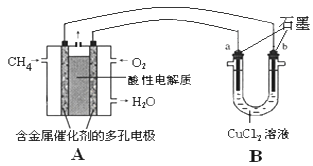
①甲烷燃料电池的负极反应式是____________
②当A中消耗0.15mol氧气时.B 中____极增重_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 处于最低能量的原子叫做基态原子
B. 3p2表示3p能级有两个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A.Na2O2是淡黄色固体, Na2O 是白色固体, 二者都能与水反应生成 NaOH
B.钠质地柔软,可用小刀切割,保存在煤油中
C.钠的还原性很强,只能以化合态存在于自然界
D.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是( ) ①道尔顿原子模型 ②汤姆生原子模型 ③卢瑟福原子模型 ④电子云模型.
A.①③②④
B.④①②③
C.④②③①
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com