
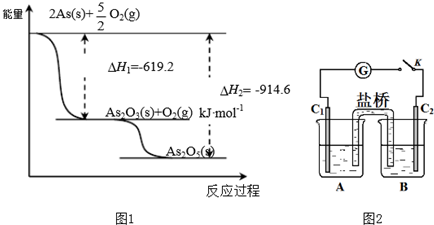
分析 (1)最外层有5个电子,由同主族位置和元素周期律可知,非金属性N>As;
(2)As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,以此书写热化学方程式;
(3)①发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应;
②向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极;
(4)①根据As2O5与NaOH溶液反应生成盐和水书写离子方程式;
②上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+反应,则消耗AsO33-的物质的量为0.02500mol•L-1×20.00×10-3L=5×10-4mol,新生成的AsO43-的物质的量也为5×10-4mol;设原As2O5 的物质的量:x,由As2O5 $\stackrel{NaOH}{→}$2AsO43-,则由As2O5 与氢氧化钠反应生成的AsO43-的物质的量为2x,后又加入过量的KI,又发生AsO42-+2I-+2H+═AsO32-+I2+H2O,析出的I2又用0.1000mol•L-1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液30.00mL,所以有AsO43-~I2~2Na2S2O3,据消耗的Na2S2O3计算.
解答 解:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(3)①B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO43-+2H++2e-=AsO33-+H2O,
故答案为:AsO43-+2H++2e-=AsO33-+H2O;
②向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏,故答案为:向左偏;
(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH-═2AsO43-+3H2O,故答案为:As2O5+6OH-═2AsO43-+3H2O;
②上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+反应,则消耗AsO33-的物质的量为0.02500mol•L-1×20.00×10-3L=5×10-4mol,新生成的AsO43-的物质的量也为5×10-4mol;设原As2O5 的物质的量:x,由As2O5 $\stackrel{NaOH}{→}$2AsO43-,则由As2O5 与氢氧化钠反应生成的AsO43-的物质的量为2x,后又加入过量的KI,又发生AsO42-+2I-+2H+═AsO32-+I2+H2O,析出的I2又用0.1000mol•L-1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液30.00mL,
所以有AsO43-~I2~2Na2S2O3
1 2
2x+5×10-4 0.1×30×10-3 解得:x=0.0005 mol
m(As2O5)=0.0005×230=0.115 g
故答案为:0.115.
点评 本题考查较综合,涉及元素的位置及元素周期律、热化学方程式、原电池的工作原理等,注重高考高频考点的考查,侧重学生分析能力及知识迁移应用能力的考查,(4)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2.26 t | B. | 1.98 t | C. | 1.65 t | D. | 1.06 t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
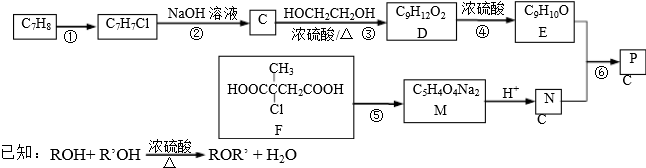
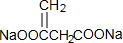 +NaCl+3H2O.
+NaCl+3H2O.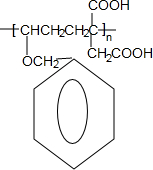 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
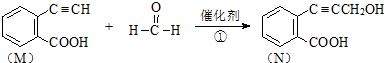
 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为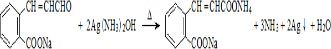 .
.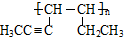
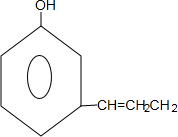
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
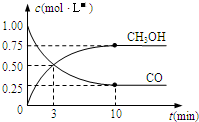 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2中都只含有离子键 | |
| B. | NaOH和NaHS都既含有离子键,又含有极性键 | |
| C. | CO2和H2S中都只含有非极性键 | |
| D. | H2O2和CS2都既含有极性键,又含有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com