
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
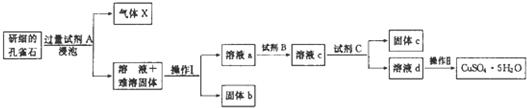
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体、溶液和固体,因为最终得到CuSO4,且能得到气体,试剂A为稀硫酸,Cu2(OH)2CO3、二价铁和三价铁的氧化物都能和稀硫酸反应生成硫酸盐,SiO2和稀硫酸不反应,所以X为CO2、溶液中溶质为CuSO4、铁的硫酸盐,过滤得到固体b为SiO2;试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B应该具有强氧化性,能氧化亚铁离子但不能引进新的杂质,所以B为双氧水;试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体e和溶液d,将溶液d蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到五水硫酸铜,据此分析解答.
解答 解:(1)通过以上分析知,A为H2SO4,操作I为分离难溶性固体和溶液,采用过滤方法,故答案为:H2SO4;过滤;
(2)通过以上分析知,操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架;
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;蒸发皿;
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,但不能引进新的杂质,所以试剂B最好选用双氧水,发生离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:B;2Fe2++2H++H2O2=2Fe3++2H2O;
(4)试剂C应该能与酸反应,增大溶液pH,使Fe3+完全转化为沉淀予以分离,而且不引入杂质,故宜选用CuCO3,稀硫酸不反应,NaOH溶液和氨水会引入杂质,故不适合;将铁离子转化为沉淀但铜离子不能转化为沉淀,所以pH范围为3.7-4.8,故答案为:D;3.7~4.8;
(5)溶液c中含有的两种金属阳离子即Fe3+和Cu2+,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后Cu2+与氨水反应生成[Cu(NH3)4]2+,所以溶液的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
故答案为:附着在滤纸上的水;惰性支持物;Cu2+;深蓝色;Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
点评 本题考查物质分离和提纯,为高频考点,涉及试剂的选取、基本实验操作、除杂等知识点,明确实验原理是解本题关键,知道每个过程发生的反应及基本操作方法,注意选取试剂时不能引进新的杂质,注意是利用氢氧化铁溶解度受pH的影响选取试剂,而不是直接用铁离子和氢氧根离子反应生成氢氧化铁,为易错点.


科目:高中化学 来源: 题型:解答题
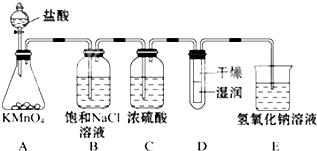 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
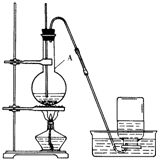
 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
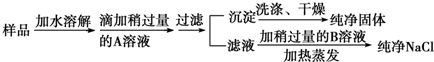
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤④①③② | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com