
| A、元素非金属性由弱到强的顺序为Z<Y<X |
| B、Y元素最高价氧化物对应水化物的化学式可表示为HYO4 |
| C、三种元素的气态氢化物中Z的气态氢化物最稳定 |
| D、原子序数由大到小的顺序为Z>Y>X |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、制取Al(OH)3:往AlCl3溶液中加入过量的NaOH溶液 |
| B、比较氯气与溴的氧化性强弱:将Cl2通入NaBr溶液中 |
| C、制取CO2:稀硫酸滴入碳酸钠固体 |
| D、除去粗盐溶液中的Ca2+、SO42-:依次加入过量的BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学方程式 | 焓变 △H/kJ?mol-1 |
活化能E/kJ?mol-1 | |
| 甲铵生成 | 2NH3(1)+CO2(1)?NH4COONH2(1) | -100.5 | 101.2 |
| 甲铵脱水 | NH4COONH2(1)?(NH2)2CO(1)+H2O(1) | +27.6 | 189.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、NO3-、Cl-、Na+ |
| B、Al3+、SO42-、Cl-、K+ |
| C、Na+、Fe2+、SO42-、NO3- |
| D、S2-、SO32-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ca2+、HCO3-、Cl- |
| B、K+、AlO2-、NO3-、I- |
| C、Na+、Cu2+、Br-、SO42- |
| D、Al3+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可用于分离苯和硝基苯的混合物 |
B、 可用于吸收HCl气体.并防止倒吸 |
C、 可用于以NH4Cl为原料,实验室制取NH3 |
D、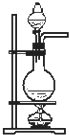 可用于实验室制取乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com