
| Ąė×Ó | Mg2+ | Cr3+ | Cl- |
| ÅØ¶Č£Ømol/L£© | 0.5 | 0.01 | a |
·ÖĪö £Ø1£©ČĪŗĪµē½āÖŹČÜŅŗÖŠ¶¼“ęŌŚµēŗÉŹŲŗć£¬øł¾ŻµēŗÉŹŲŗć¼ĘĖćaÖµ£»
£Ø2£©Cr3+²śÉś³ĮµķŹ±ČÜŅŗÖŠc£ØOH-£©=$\root{3}{\frac{{K}_{sp}[Cr£ØOH£©_{3}]}{c£ØC{r}^{3+}£©}}$£¬Mg2+²śÉś³ĮµķŹ±ČÜŅŗÖŠc£ØOH-£©=$\sqrt{\frac{{K}_{sp}[Mg£ØOH£©_{2}]}{c£ØM{g}^{2+}£©}}$£¬“Ó¶ųČ·¶ØČÜŅŗpH·¶Ī§£»
£Ø3£©ÓÉĀĖŅŗÖĘČ”ĀČ»ÆĆ¾¾§Ģå£ØMgCl2?6H2O£©µÄ²Ł×÷ŹĒ¼ÓČČÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ£®
½ā“š ½ā£ŗ£Ø1£©ČĪŗĪµē½āÖŹČÜŅŗÖŠ¶¼“ęŌŚµēŗÉŹŲŗć£¬øł¾ŻµēŗÉŹŲŗćµĆc£ØCl-£©+c£ØOH-£©=2c£ØMg2+£©+3c£ØCr3+£©+c£ØH+£©£¬ĀČ»ÆĆ¾”¢ĀČ»ÆøõČÜŅŗ¶¼³ŹĖįŠŌ£¬ĖłŅŌ£ØCl-£©£¾2c£ØMg2+£©+3c£ØCr3+£©=£Ø2”Į0.5+0.01”Į3£©mol/L=1.03mol/L£¬Ōņa£¾1.03£¬¹Ź“š°øĪŖ£ŗ£¾£»
£Ø2£©Cr3+²śÉś³ĮµķŹ±ČÜŅŗÖŠc£ØOH-£©=$\root{3}{\frac{{K}_{sp}[Cr£ØOH£©_{3}]}{c£ØC{r}^{3+}£©}}$=$\root{3}{\frac{1{0}^{-32}}{0.01}}$mol/L=10-10mol/L£¬ČÜŅŗµÄpH=4£¬
Cr3+²śÉś³ĮµķĶźČ«Ź±ČÜŅŗÖŠc£ØOH-£©=$\root{3}{\frac{{K}_{sp}[Cr£ØOH£©_{3}]}{c£ØC{r}^{3+}£©}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L£¬ČÜŅŗµÄpH=5£¬
Mg2+²śÉś³ĮµķŹ±ČÜŅŗÖŠc£ØOH-£©=$\sqrt{\frac{{K}_{sp}[Mg£ØOH£©_{2}]}{c£ØM{g}^{2+}£©}}$=$\sqrt{\frac{5”Į1{0}^{-11}}{0.5}}$mol/L=10-5mol/L£¬ČÜŅŗµÄpHĪŖ9£¬µ÷½ŚČÜŅŗµÄpHŅŖ³żČ„øõĄė×Óµ«²»ÄܲśÉśĒāŃõ»ÆĆ¾³Įµķ£¬ĖłŅŌŠčŅŖµ÷½ŚČÜŅŗµÄpH·¶Ī§ĪŖ5”ÜpH£¼9£¬¹Ź“š°øĪŖ£ŗ5”ÜpH£¼9£»
£Ø3£©ÓÉĀĖŅŗÖĘČ”ĀČ»ÆĆ¾¾§Ģå£ØMgCl2?6H2O£©µÄ²Ł×÷ŹĒ¼ÓČČÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ£¬ŅņĪŖĀČ»ÆĆ¾Ņ×Ė®½ā£¬ĪŖ·ĄÖ¹ĘäĖ®½ā£¬Ó¦øĆŌŚHCl·ÕĪ§ÖŠ¼ÓČČÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖ£¬¹Ź“š°øĪŖ£ŗŌŚHCl·ÕĪ§ÖŠ¼ÓČČÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖ£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹ·ÖĄėŗĶĢį“攢ÄŃČÜĪļÓŠ¹Ų¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦£¬×ŪŗĻŠŌ½ĻĒ棬ÄѵćŹĒČÜŅŗpH·¶Ī§µÄÅŠ¶Ļ£¬×¢ŅāĀČ»ÆĆ¾Ņ×Ė®½āµÄĢŲµć£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Fe+CuSO4ØTFeSO4+Cu | B£® | Fe2O3+3CO$\frac{\underline{\;\;”÷\;\;}}{\;}$2Fe+3CO2 | ||
| C£® | AgNO3+NaClØTAgCl”ż+NaNO3 | D£® | NH4HCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O+CO2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
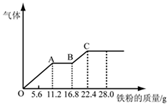 ĻņĻ”ĮņĖįŗĶĻ”ĻõĖįµÄ»ģŗĻČÜŅŗ200mLÖŠÖš½„¼ÓČėĢś·Ū£¬²śÉśĘųĢåµÄĮæĖęĢś·ŪÖŹĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£ØŅŃÖŖĻõĖįÖ»±»»¹ŌĪŖNOĘųĢ壩£®ĻĀĮŠ·ÖĪö“ķĪóµÄŹĒ£Ø””””£©
ĻņĻ”ĮņĖįŗĶĻ”ĻõĖįµÄ»ģŗĻČÜŅŗ200mLÖŠÖš½„¼ÓČėĢś·Ū£¬²śÉśĘųĢåµÄĮæĖęĢś·ŪÖŹĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£ØŅŃÖŖĻõĖįÖ»±»»¹ŌĪŖNOĘųĢ壩£®ĻĀĮŠ·ÖĪö“ķĪóµÄŹĒ£Ø””””£©| A£® | OA¶Ī²śÉśµÄŹĒNO£¬AB¶ĪµÄ·“Ó¦ĪŖFe+2Fe3+=3Fe2+£¬BC¶Ī²śÉśH2 | |
| B£® | AµćČÜŅŗÖŠµÄČÜÖŹĪŖFe£ØNO3£©3ŗĶH2SO4 | |
| C£® | Ō»ģŗĻĖįÖŠNO3-ĪļÖŹµÄĮæĪŖ0.2mol | |
| D£® | Ō»ģŗĻĖįÖŠH2SO4µÄĪļÖŹµÄĮæÅضČĪŖ2mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ńō¹āĶø¹żĒ½ÉĻµÄŠ”æ×ŌŚ½Ļ°µµÄ·æ¼äĄļŠĪ³ÉŅ»µĄµĄ¹āÖł | |
| B£® | ÓĆŹÆøą»ņŃĪĀ±Öʶ¹øÆ | |
| C£® | ĻņFeCl3ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ³öĻÖŗģŗÖÉ«³Įµķ | |
| D£® | ³¤½Čż½ĒÖŽµÄŠĪ³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2CO3ŗĶNaHCO3¾łæÉÓėNaOHČÜŅŗ·“Ó¦ | |
| B£® | NaHCO3±ČNa2CO3ČČĪČ¶ØŠŌĒæ | |
| C£® | ĻąĶ¬ĪļÖŹµÄĮæµÄNa2CO3ŗĶNaHCO3Óė×ćĮæŃĪĖį×÷ÓĆŹ±£¬²śÉśµÄĘųĢåµÄĮæĻąĶ¬ | |
| D£® | ĻąĶ¬ÖŹĮæµÄNa2CO3ŗĶNaHCO3Óė×ćĮæŃĪĖį×÷ÓĆŹ±£¬¶žÕßĻūŗĵÄŃĪĖįŅ»Ńł¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
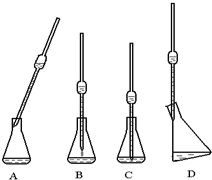 ij²ŻĖį¾§ĢåµÄ»ÆѧŹ½æɱķŹ¾ĪŖH2C2O4•xH2O£¬ĪŖ²ā¶ØxµÄÖµ£¬½ųŠŠĻĀĮŠŹµŃé£ŗ
ij²ŻĖį¾§ĢåµÄ»ÆѧŹ½æɱķŹ¾ĪŖH2C2O4•xH2O£¬ĪŖ²ā¶ØxµÄÖµ£¬½ųŠŠĻĀĮŠŹµŃé£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 30% | B£® | 20% | C£® | 15% | D£® | 10% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāĘųŌŚŃõĘųÖŠµćČ¼ | |
| B£® | µŖĘųÓėĒāĘųŌŚøßĪĀøßŃ¹ŗĶÓŠ“߻ƼĮĢõ¼žĻĀ·“Ó¦ | |
| C£® | ĒāŃõ»ÆÄĘČÜŅŗÓėŃĪĖį»ģŗĻ | |
| D£® | ¶žŃõ»ÆµŖÓėŃõĘų·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com