
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
分析 A.酸碱抑制水的电离,水解的盐促进水的电离;
B.反应自发进行的判断依据是△H-T△S<0分析;
C.向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,氢氧化镁和氢氧化铜阴阳离子比相同,溶度积越大越溶于水,说明氢氧化铜溶度积小于氢氧化镁;
D.加入适量CCl4,碘溶解在CCl4层显紫色.
解答 解:A.常温下,PH均为9的CH3COONa和NaOH溶液中,氢氧根离子浓度相同,酸碱抑制水的电离,水解的盐促进水的电离,水的电离程度不相同,故A正确;
B.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则△H-T△S<0,反应△S<0,则该反应的△H<0才能满足△H-T△S<0,故B错误;
C.向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀为氢氧化铜沉淀,氢氧化镁和氢氧化铜阴阳离子比相同,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2],故C正确;
D.加入适量CCl4,碘溶解在CCl4层显紫色,则由现象可知I2在CCl4中的溶解度比在水中的大,故D错误;
故选AC.
点评 本题考查了盐类水解、影响水电离平衡因素、溶度积常数的分析应用、反应自发进行的判断依据、物质溶解性比较等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极和电解池阳极 | B. | 电解池阳极和电解池阴极 | ||
| C. | 原电池负极和电解池阳极 | D. | 原电池的正极和原电池负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成 SO3 为2 mol | |
| B. | 反应完全停止 | |
| C. | SO2 和 SO3物质的量之和为 2mol | |
| D. | SO2 的物质的量和SO3物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
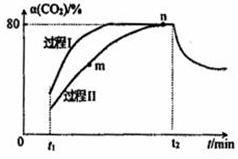 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
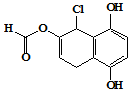
| A. | 不能发生银镜发应,能发生水解反应 | |
| B. | 1mol 该物质最多可与含2mol溴单质的浓溴水反应 | |
| C. | 1mol 该物质最多可与4molNaOH反应 | |
| D. | 与Na、NaHCO3、Na2CO3均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙使Br-全部转化为溴单质 | |
| C. | 用装置丙分液时先从下口放出水层,再从上口倒出有机层 | |
| D. | 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molHCl气体 | B. | 0.1molNa2SO4固体 | ||
| C. | 0.2molNaOH固体 | D. | 0.1mol葡萄糖晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com