
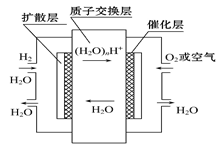
| A.正极通入H2,发生还原反应 |
| B.负极通入H2,发生还原反应 |
| C.导电离子为质子,且在电池内部由正极定向移向负极 |
| D.总反应式为2H2+O2 = 2H2O |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

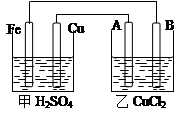
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
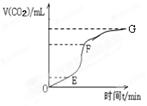

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0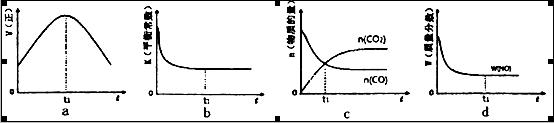
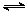 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②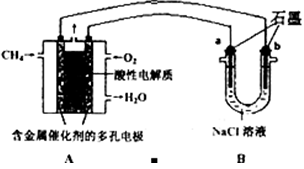
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
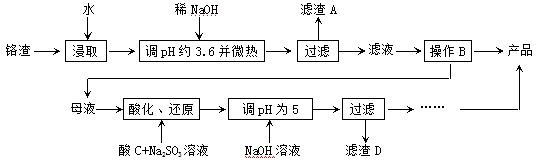
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.此装置能将化学能转变为电能 |
| B.石墨电极的反应式:O2+2H2O+4e—=4OH— |
| C.电子由Cu电极经导线流向石墨电极 |
| D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com