
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、2a-bkJ?mol-1 | ||
| D、b-2akJ?mol |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
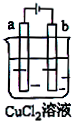
| A、电极a表面呈红色 |
| B、电极b表面有气泡生成 |
| C、电子由电源的正极沿导线流向电极a |
| D、该装置能量转化形式为电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①完全燃烧后的产物中n(CO2):n(H2O)=2:1 ②28<Mr(A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 ⑤碳碳之间都是单键 |
| B | ①饱和链烃,通常情况下呈气态 ②存在同分异构体 ③二溴代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
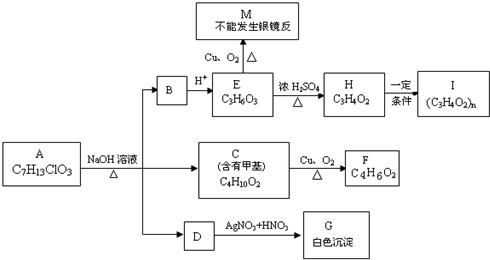
查看答案和解析>>
科目:高中化学 来源: 题型:
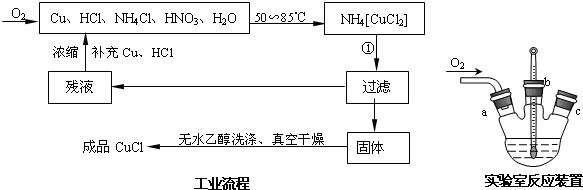

查看答案和解析>>
科目:高中化学 来源: 题型:
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 24.95 | 24.45 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.55 | 24.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com