
 在一个体积为2L的密闭容器中,高温下发生下列反应:
在一个体积为2L的密闭容器中,高温下发生下列反应:| 0.4mol |
| 2L×1min |
| c(CO) |
| c(CO2) |
| m |
| v |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、乙酸的分子式为CH3COOH,属于弱电解质 |
| B、食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| C、乙醇中是否含有水,可用无水硫酸铜来检验 |
| D、乙醇和乙酸的熔点和沸点都比C2H6、C2H4的熔点和沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①②③④⑤均属于氧化还原反应 |
| B、反应⑤说明该条件下铝可用于制熔点较高的金属 |
| C、相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D、反应①中氧化剂与还原剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
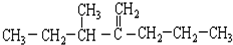 此烃名称为
此烃名称为 的烃可命名为
的烃可命名为 的烃可命名为:
的烃可命名为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com