
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 硬度由大到小:金刚石>碳化硅>晶体硅 |
分析 A.均为分子晶体,相对分子质量越大,熔点越大;
B.离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强;
C.影响金属晶体金属键强弱的因素为电荷和离子半径;
D.原子晶体中共价键越强,晶体硬度越大.
解答 解:A.均为分子晶体,相对分子质量越大,熔点越大,则晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A正确;
B.离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故B错误;
C.Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C正确;
D.原子半径Si>C,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,则硬度由大到小:金刚石>碳化硅>晶体硅,故D正确.
故选B.
点评 本题考查晶体及性质,为高频考点,把握晶体类型及作用力、晶体性质比较方法为解答的关键,侧重分析与应用能力的考查,注意晶体结构与性质的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
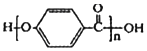 的结构中含有酯基
的结构中含有酯基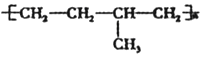 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得| A. | ①③⑤ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| B. | 稀硫酸中:K+、Mg2+、AlO2-、S2O32- | |
| C. | 常温下:$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入硫氰化钾显红色的溶液:K+、NH4+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图示实验中发生了化学变化 | |
| B. | 液体X的pH>7,液体Y是一种黑色黏稠状液体 | |
| C. | 气体Z易燃,可还原CuO | |
| D. | 液体Y是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氧化还原反应 | B. | 铜是还原剂 | ||
| C. | 部分H2SO4被还原 | D. | Cu发生了还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com