
ЗвСхИјБПөзіШКЗ·ыәПВМЙ«»ҜС§АнДоөДРВРН·ўөзЧ°ЦГЎЈ
ПВНјОӘөзіШКҫТвНјЈ¬ёГөзіШөзј«ұнГж¶ЖТ»ІгПёРЎөДІ¬·ЫЈ¬І¬ОьёҪЖшМеөДДЬБҰЗҝЈ¬РФЦКОИ¶ЁЈ¬Зл»ШҙрЈә
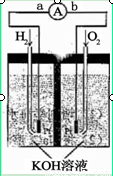
ЈЁ1Ј©ЗвСхИјБПөзіШөДДЬБҝЧӘ»ҜЦчТӘРОКҪКЗЎЎЎЎЎЎЎЎЎЎЎЎЈ¬ФЪөјПЯЦРөзЧУБч¶Ҝ·ҪПтОӘ ЎЎЎЎЎЎЎЎЎЎЈЁУГaЎўb ұнКҫЈ©ЎЈ
ЈЁ2Ј©ёәј«·ҙУҰКҪОӘЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЈ
ЈЁ3Ј©өзј«ұнГж¶ЖІ¬·ЫөДФӯТтОӘЎЎЎЎЎЎЎЎЎЎ ЎЈ
ЈЁ4Ј©ёГөзіШ№ӨЧчКұЈ¬H2әНO2Б¬РшУЙНвІҝ№©ёшЈ¬өзіШҝЙБ¬РшІ»¶ПМṩөзДЬЎЈТтҙЛЈ¬ҙуБҝ°ІИ«ҙўЗвКЗ№ШјьјјКхЦ®Т»ЎЈҪрКфп®КЗТ»ЦЦЦШТӘөДҙўЗвІДБПЈ¬ОьЗвәН·ЕЗвФӯАнИзПВЈә
ўс.2Li+H2  2LiH
2LiH
ўт.LiH+H2O=LiOH+H2Ўь
ўЩ·ҙУҰўсЦРөД»№ФӯјБКЗЎЎЎЎЎЎЎЎЎЎЈ¬·ҙУҰўтЦРөДСх»ҜјБКЗЎЎЎЎЎЎЎЎЎЎЎЈ
ўЪУЙLiHУлH2OЧчУГЈ¬·ЕіцөД224LЈЁұкЧјЧҙҝцЈ©H2УГЧчөзіШИјБПЈ¬ИфДЬБҝЧӘ»ҜВКОӘ80ЈҘЈ¬ФтөјПЯЦРНЁ№эөзЧУөДОпЦКөДБҝОӘЎЎЎЎЎЎ ЎЎmolЎЈ
ЈЁ1Ј©УЙ»ҜС§ДЬЧӘұдОӘөзДЬЈЁ1·ЦЈ© УЙaөҪbЈЁ1·ЦЈ©
ЈЁ2Ј©2H2+4OHЎӘ-4e-=4H2O»тH2+2OHЎӘ-2e-=2H2OЈЁ2·ЦЈ©
ЈЁ3Ј©Фцҙуөзј«өҘО»Гж»эОьёҪH2ЎўO2·ЦЧУКэЈ¬јУҝмөзј«·ҙУҰЛЩВКЈ»»тФцҙуөзј«ЙПH2ЎўO2ЖшМеөДЕЁ¶ИЈ¬јУҝм·ҙУҰЛЩВКЎЈЈЁ2·ЦЈ©
ЈЁ4Ј©ўЩLiЈЁ1·ЦЈ© H2O ЈЁ1·ЦЈ© ўЪ16ЈЁ2·ЦЈ©
ЎҫҪвОцЎҝ
КФМвҪвОцЈәЈЁ1Ј©ЗвСхИјБПөзіШКЗАыУГБЛФӯөзіШөД№ӨЧчФӯАнЈ¬ЛщТФКЗ°С»ҜС§ДЬЧӘ»ҜОӘөзДЬөДЧ°ЦГЎЈФЪЧ°ЦГЦРЈ¬өзЧУөДБчПтКЗҙУёәј«БчПтХэј«Ј¬НјЦРaОӘёәј«Ј¬bОӘХэј«Ј¬ЛщТФөзЧУҙУaБчПтbЎЈ
ЈЁ2Ј©ёәј«КЗЗвЖш·ўЙъСх»Ҝ·ҙУҰЈ¬ҪбәПөзҪвЦКИЬТәЈ¬өзј«·ҙУҰКҪОӘ2H2+4OHЎӘ-4e-=4H2O»тH2+2OHЎӘ-2e-=2H2OЎЈ
ЈЁ3Ј©УЙМвДҝЦРЛщКцЈ¬І¬ОьёҪЖшМеөДДЬБҰЗҝЈ¬РФЦКОИ¶ЁЈ¬ЛщТФөзј«ұнГж¶ЖІ¬·ЫөДДҝөДКЗФцҙуөзј«өҘО»Гж»эОьёҪH2ЎўO2·ЦЧУКэЈ¬јУҝмөзј«·ҙУҰЛЩВКЈ»»тХЯКЗФцҙуөзј«ЙПH2ЎўO2ЖшМеөДЕЁ¶ИЈ¬јУҝм·ҙУҰЛЩВКЎЈ
ЈЁ4Ј©ўЩ»№ФӯјБКЗЦёФӘЛШ»ҜәПјЫЙэёЯөДОпЦКЈ¬ФЪўсЦРLiөД»ҜәПјЫЙэёЯЈ¬ЛщТФLiКЗ»№ФӯјБЈ»Сх»ҜјБКЗЦёФӘЛШ»ҜәПјЫҪөөНөДОпЦКЈ¬ФЪўтЦРH2OЦРЗвФӘЛШөД»ҜәПјЫҪөөНЈ¬ЛщТФH2OЧчСх»ҜјБЎЈ
ўЪ·ЕіцөДH2өДОпЦКөДБҝОӘ10molЈ¬УЙУЪДЬБҝЧӘ»ҜВКОӘ80%Ј¬КөјКІОјУ·ҙУҰөДH2өДОпЦКөДБҝОӘ10molЎБ80%=8mol, H2өДОпЦКөДБҝОӘ8mol, H2-2e-=2H+ФтөјПЯЙПНЁ№эөДөзЧУөДОпЦКөДБҝОӘ8molЎБ2=16molЎЈ
ҝјөгЈәҝјІйЗвСхИјБПөзіШөД№ӨЧчФӯАнЎўөзЧУБчПтЎўПаУҰјЖЛг


 ҝЪЛгМвҝЁјУУҰУГМвјҜСөПөБРҙр°ё
ҝЪЛгМвҝЁјУУҰУГМвјҜСөПөБРҙр°ё ЧЫәПЧФІвПөБРҙр°ё
ЧЫәПЧФІвПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмХгҪӯКЎёЯ¶юПВС§ЖЪөЪТ»ҙОЦКБҝјмІв»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәМоҝХМв
(1)ПВБРёчЧй»ҜәПОпЦРЈ¬КфУЪН¬ПөОпөДКЗ?МоИлұаәЕ? Ј¬КфУЪН¬·ЦТм№№МеөДКЗ?МоИлұаәЕ? ЎЈ
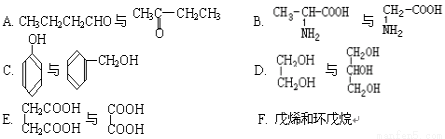
(2)УР»ъОпAЈә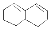 ФЪјУИИМхјюПВәНBr2 °ҙОпЦКөДБҝЦ®ұИ1Јә1·ўЙъөД·ЗБЪО»МјөДјУіЙ·ҙУҰ·ҪіМКҪ ЎЈ
ФЪјУИИМхјюПВәНBr2 °ҙОпЦКөДБҝЦ®ұИ1Јә1·ўЙъөД·ЗБЪО»МјөДјУіЙ·ҙУҰ·ҪіМКҪ ЎЈ
ЈЁ3)ДіёЯ·ЦЧУУР»ъОп КЗУЙТ»ЦЦөҘМеЛхҫЫ¶шіЙөДЈ¬ёГөҘМеөДҪб№№јтКҪОӘ ЎЈ
КЗУЙТ»ЦЦөҘМеЛхҫЫ¶шіЙөДЈ¬ёГөҘМеөДҪб№№јтКҪОӘ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУДПРнІэКРОеРЈёЯ¶юПВС§ЖЪөЪТ»ҙОБӘҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
AЈ®ЗҰРоөзіШ·ЕөзКұөДёәј«әНідөзКұөДСфј«ҫщ·ўЙъ»№Фӯ·ҙУҰ
BЈ®Иј·ЕөДСж»рКЗДіР©ҪрКфФӘЛШСжЙ«·ҙУҰЛщіКПЦіцөДЙ«ІКЈ¬СжЙ«·ҙУҰКфУЪ»ҜС§ұд»Ҝ
CЈ®АыУГ¶Ўҙп¶ыПЦПуҝЙТФЗш·ЦЗвСх»ҜМъҪәМеәНБтЛбНӯИЬТә
DЈ®№ӨТөЙПЦЖҙЦ№иөДЦчТӘ·ҙУҰ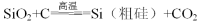
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУДПКЎВеСфКРёЯ¶юЙПС§ЖЪЖЪД©јмІв»ҜС§КФҫнЈЁAЈ©ЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ФЪЦё¶ЁөДМхјюПВЈ¬ПВБРёчЧйАлЧУТ»¶ЁДЬҙуБҝ№ІҙжөДКЗ
AЈ®ОЮЙ«өДИЬТәЦРЈәFe3+ЎўK+ЎўNO3ЈӯЎўClЈӯ
BЈ®pHЈҪ13өДИЬТәЦРЈәNH4+ЎўNa+ЎўSO42ЈӯЎўClЈӯ
CЈ®ә¬УРҙуБҝBa2+ өДИЬТәЦРЈәNH4+ЎўNa+ЎўClЈӯЎўH+
DЈ®c(H+)ЈҪ0Ј®1 molЎӨLЈӯ1өДИЬТәЦРЈәK+ЎўIЈӯЎўClЈӯЎўNO3Јӯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУДПКЎВеСфКРёЯ¶юЙПС§ЖЪЖЪД©јмІв»ҜС§КФҫнЈЁAЈ©ЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ПВБРУР№ШКөСйФӯАн»тКөСйІЩЧчХэИ·өДКЗ
AЈ®УГХфБуЛ®КӘИуөДpHКФЦҪІвБҝДіИЬТәөДpH=10
BЈ®УГ10 mLБҝНІБҝИЎ0Ј®50 molЎӨЈМ-1H2SO4ИЬТә5Ј®50 mL
CЈ®ПтМъ¶ӨЙП¶ЖНӯКұЈ¬Мъ¶ӨБ¬ҪУЦұБчөзФҙөДХэј«
DЈ®КўЧ°Na2CO3ИЬТәөДКФјБЖҝТӘК№УГҪәИы
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУұұКЎәӘөҰКРёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
өзҪвБтЛбИЬТәКұЈ¬·Еіц25mLЈЁұкҝцЈ©O2Ј¬ИфТФөИБҝөДөзБҝФЪН¬СщМхјюПВөзҪвСОЛбИЬТәЈ¬
Лщ·ЕіцөДЖшМеөДМе»эЧоҪУҪьПВБРКэҫЭЦРөД ЎЎ
AЈ®45mL ЎЎ BЈ®50mLЎЎ CЈ®75mL DЈ®100mL
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУұұКЎәӘөҰКРёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ПВБРЛө·ЁХэИ·өДКЗ
AЈ®ЗҝөзҪвЦКИЬТәөДөјөзДЬБҰТ»¶ЁұИИхөзҪвЦКИЬТәөДЗҝ
BЈ®Т»¶ЁОВ¶ИПВЈ¬ҝЙДж·ҙУҰ2X ЈЁgЈ©Ј«Y ЈЁgЈ©  2Z ЈЁgЈ©ҙпөҪЖҪәвөДұкЦҫКЗЈәИЭЖчДЪXЎўYЎўZөДОпЦКөДБҝЦ®ұИОӘ2Јә1Јә2
2Z ЈЁgЈ©ҙпөҪЖҪәвөДұкЦҫКЗЈәИЭЖчДЪXЎўYЎўZөДОпЦКөДБҝЦ®ұИОӘ2Јә1Јә2
CЈ®ЙэёЯОВ¶ИЈ¬AgClөДИЬҪв¶ИФцҙуЈ¬KspФцҙу
DЈ®FeCl3 ЎўKAlЈЁSO4Ј©2ЎўNa2CO3өДЛ®ИЬТәҫщПФЛбРФ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмәУұұКЎёЯ¶юПВС§ЖЪөЪТ»ҙОФВҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
јЧИ©ЎўТТЛбәНұыИ©ЧйіЙөД»мәПОпЦРЈ¬СхФӘЛШөДЦКБҝ·ЦКэКЗ37%Ј¬ФтМјФӘЛШөДЦКБҝ·ЦКэОӘ
AЈ®27% BЈ® 28% CЈ® 54% DЈ®ОЮ·ЁјЖЛг
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмҪӯОчКЎёУЦЭКРБщРЈёЯ¶юЙПС§ЖЪЖЪД©БӘҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәМоҝХМв
ҫЭЎ¶БЙЙтНнұЁЎ·ұЁөАЈ¬ҪсД궬МмЈ¬Т»ө©іцПЦҙуЖшСПЦШОЫИҫөДМмЖшЈ¬ЙтСфКРУРҝЙДЬҪЁТйХюё®»ъ№ШЎўЖуКВТөөҘО»ёщҫЭКөјКЗйҝцКөРРФұ№ӨРЭјЩ»төҜРФ№ӨЧчЦЖЎЈҙуЖшә¬УРөДCOЎўөӘСх»ҜОпЎўSO2ЎўСМіҫөИОЫИҫКЗөјЦВОнцІМмЖшөДФӯТтЦ®Т»Ј¬»ҜС§·ҙУҰФӯАнКЗјхЙЩәНҝШЦЖОнцІМмЖшөДАнВЫТАҫЭЎЈ
ЈЁ1Ј©CO2ҫӯіЈУГЗвСх»ҜДЖАҙОьКХЈ¬ПЦУР0.4molCO2Ј¬ИфУГ200ml 3mol/LNaOHИЬТәҪ«ЖдНкИ«ОьКХЈ¬ИЬТәЦРАлЧУЕЁ¶ИУЙҙуөҪРЎөДЛіРтОӘЈә
ЈЁ2Ј© COҝЙЦЖЧцИјБПөзіШЈ¬ТФKOHИЬТәЧчөзҪвЦКЈ¬ПтБҪј«·ЦұрідИлCOәНҝХЖшЈ¬№ӨЧч№эіМЦРЈ¬Ј¬ёәј«·ҙУҰ·ҪіМКҪОӘЈә___________________ЎЈ
ЈЁ3Ј© АыУГFe2+ЎўFe3+өДҙЯ»ҜЧчУГЈ¬іЈОВПВҪ«SO2ЧӘ»ҜОӘSO42ЈӯЈ¬ҙУ¶шКөПЦ¶ФSO2өДҙҰАн(ЧЬ·ҙУҰОӘ2SO2+O2+2H2OЈҪ2H2SO4)ЎЈТСЦӘЈ¬ә¬SO2өД·ПЖшНЁИлә¬Fe2+ЎўFe3+өДИЬТәКұЈ¬ЖдЦРТ»ёц·ҙУҰөДАлЧУ·ҪіМКҪОӘ4Fe2+ + O2+ 4H+ ЈҪ4Fe3+ + 2H2OЈ¬ФтБнТ»·ҙУҰөДАлЧУ·ҪіМКҪОӘ Ј»
ЈЁ4Ј©CO2ФЪЧФИ»ҪзСӯ»·КұҝЙУлCaCO3·ҙУҰЈ¬CaCO3КЗТ»ЦЦДСИЬОпЦКЈ¬ЖдKsp=2.8ЎБ10ЎӘ9ЎЈCaCl2ИЬТәУлNa2CO3ИЬТә»мәПҝЙРОіЙCaCO3іБөнЈ¬ПЦҪ«өИМе»эөДCaCl2ИЬТәУлNa2CO3ИЬТә»мәПЈ¬ИфNa2CO3ИЬТәөДЕЁ¶ИОӘ2ЎБ10ЎӘ4mo1/L Ј¬ФтЙъіЙіБөнЛщРиCaCl2ИЬТәөДЧоРЎЕЁ¶ИОӘ ЎЈ
ЈЁ5Ј©ТСЦӘФЪіЈОВіЈС№ПВЈә
ўЩCH3OH(l)+O2(g)= CO(g)+2H2O(g) ЎчH= -359.8 kJЎӨmolЈӯ1
ўЪ 2CO(g)Ј«O2(g)=2CO2(g) ?ЎчH= -556.0 kJЎӨmolЈӯ1
ўЫ H2O(g)=H2O(l)? ЎчH= -44.0 kJЎӨmolЈӯ1
РҙіцМеПЦјЧҙјИјЙХИИөДИИ»ҜС§·ҪіМКҪ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com