
����Ŀ���� 2L �ݻ�������ܱ������ڣ�800��ʱ��Ӧ 2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����O2�ķ�Ӧ���ʱ�ʾ 0��2s �ڸ÷�Ӧ��ƽ����Ӧ���� v= �� ��������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��÷�Ӧ���ȷ�Ӧ��
��2��ͼ�б�ʾNO2Ũ�ȱ仯��������������ĸ���� 
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.v��NO2��=2v��O2��
B.�����ڵ�ѹǿ���ֲ���
C.v����NO��=2v����O2��
D.�����������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����������ţ���
A.��ʱ�����NO2
B.�ʵ������¶�
C.����O2��Ũ��
D.ѡ���Ч������
���𰸡�
��1��1.5��10��3mol?L��1?s��1����
��2��b
��3��BC
��4��C
���������⣺��1.��2s����NO��ʾ��ƽ����Ӧ����v��NO��= ![]() =
= ![]() =3.0��10��3molL��1s��1 �� ����֮�ȵ��ڻ�ѧ������֮�ȣ� ����v��O2��=
=3.0��10��3molL��1s��1 �� ����֮�ȵ��ڻ�ѧ������֮�ȣ� ����v��O2��= ![]() v��NO��=
v��NO��= ![]() ��3.0��10��3molL��1s��1=1.5��10��3molL��1s��1 ��
��3.0��10��3molL��1s��1=1.5��10��3molL��1s��1 ��
������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��ԭƽ�����ʵ����࣬˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
���Դ��ǣ�1.5��10��3molL��1s��1���ţ�
��2.��NO2�Dz���淴Ӧ����Ũ������ƽ��ʱŨ��ΪNOŨ�ȵı仯����c��NO��= ![]() =0.0065mol/L������ͼ�б�ʾNO2�仯��������b��
=0.0065mol/L������ͼ�б�ʾNO2�仯��������b��
���Դ��ǣ�b��
��3.��A����ʾͬһ����Ӧ���ʣ�v��NO2����ʼ����Ϊv��O2����2��������˵���ﵽƽ�⣬��A����
B���淴Ӧ���У���Ӧ��������ܵ����ʵ����ڼ�С�����������ʵ������ֲ��䣬�����ڵ�ѹǿ���ֲ��䣬˵����Ӧ����ƽ�⣬��B��ȷ��
C����ͬ���ʱ�ʾ���ʣ�����ƽ��ʱ����������֮�ȵ��ڻ�ѧ������֮�ȣ�V�� ��NO��������O2��=2��1����V�� ��NO��=2v����O2������C��ȷ��
D�������������������䣬�����ݻ�Ϊ��ֵ�������ܶ���ʼ���ղ��䣬����˵���ﵽƽ�⣬��D����
���Դ��ǣ�BC��
��4.��2NO��g��+O2��g���T2NO2��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����ȡ���д�ʩ��������ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ���
A����ʱ�����NO2���壬����������Ũ�ȣ�ƽ��������У�����Ӧ���ʼ�С����A����
B�������¶ȣ�ƽ�������ƶ�����B����
C������O2��Ũ�ȣ���ѧ��Ӧ���ʼӿ죬ƽ�������ƶ�����C��ȷ��
D��ѡ���Ч��������ѧ��Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����D����
���Դ��ǣ�C��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)����Ҫ���ջ�ѧƽ��״̬���ж�(״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y����)�����֪ʶ���Ǵ���Ĺؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϩ�ܷ�������ת���� 
��1����ϩ�ĽṹʽΪ�� ��
��2��д������������ŵĻ�ѧʽ�����ƣ�B�к������ŵĻ�ѧʽ��������������
��3��д����Ӧ�Ļ�ѧ����ʽ�ڣ���Ӧ���ͣ��ۣ���Ӧ���ͣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL��1 NaOH��Һ�ֱ�ζ�20.00mL 0.100molL��1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ���ǣ� �� 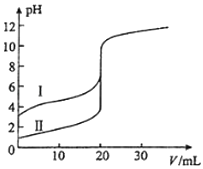
A.���ʾ���ǵζ����������
B.pH=7ʱ���ζ��������ĵ�V��NaOH��С��20mL
C.V��NaOH��=20.00mLʱ��������Һ��c��Cl����=c��CH3COO����
D.V��NaOH��=10.00mLʱ��������Һ��c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£�ˮ��Һ��H+��OH-��Ũ�ȱ仯������ͼ������˵����ȷ���ǣ� ��
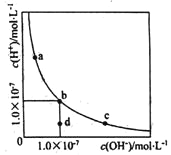
A. �����¶ȣ�����������c��b�ı仯
B. ���¶��£�ˮ�����ӻ�����Ϊl.0��10-13
C. ���¶��£�����FeCl3����������b��a�ı仯
D. ���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H��1O ![]() 3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
A.�ŵ�ʱÿת��3mol���ӣ�������1mol K2FeO4������
B.���ʱ������ӦΪ��Fe��OH��3��3e��+5 OH���TFeO ![]() +4H2O
+4H2O
C.�ŵ�ʱ����������Һ�ļ�����ǿ
D.�ŵ�ʱ������ӦΪ��Zn��2e��+2OH���TZn��OH��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ�����ӷ���ʽ�������ӷ�Ӧ�ģ�ֻд���ӷ���ʽ����
��1��ʵ������������ ��
��2����������ˮ�У� ��
��3����ʯӢɰ�ƴֹ裺 ��
��4�����Ȼ�����Һ����ӡˢ��·�壺 ��
��5����ƫ��������Һ��ͨ������Ķ�����̼�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1���ؿ��к�����һ����Ԫ�ع��ɵĵ���A�뻯����B��������Ϊ232�������û���Ӧ������Ϊ��ɫ����C����һ����D������D��ˮ�����ڸ����¿ɵõ�B����
��i��д�����ɽ�������A��Ԫ�������ڱ��е�λ��Ϊ ��
��ii��д��D��ˮ������Ӧ�Ļ�ѧ����ʽ ��
��2��ij��ú��ʯ��Ԥ������SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�����ȣ�һ���ۺ����ù���������£� 
��i������X�Ļ�ѧʽΪ �� �����ܡ�ʱ��Ӧ�����ӷ���ʽΪ ��
��ii��Ϊ�ӿ조�����ʱ�����ʣ��ɲ�ȡ�Ĵ�ʩ�����ȣ��������ּ��ɣ�
��iii����֪Fe3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ2.1��3.2��Al3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.1��5.4��Ϊ�˻�ø����ƷAl��OH��3 �� ��ú��ʯ�������ȡҺ��ʼ����ֻ��CaCO3һ���Լ�������������ʵ�鷽���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ���Һ������CO2��Ӧ���ǣ� ��
A. Na2O2B. CaCl2��ҺC. NaOH��ҺD. Na2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2Cl2���������Ȼ������Ȼǻ������緼���廯������Ȼ���������Ȼ������������л�������������Ȼ���Ҳ��������ҩƷ��ȼ�ϡ�������Լ��ȣ�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�������ס����̡���100�����ϱ㿪ʼ�ֽ�Ϊ�����������������ҵ�ϳ������������ϳ������ȣ�������Ķ��������������һ�������½��з�Ӧ���䷴Ӧԭ����ʵ��װ�����£�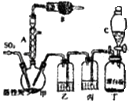
SO2��g��+Cl2��g�� ![]() SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
��1������A��������
��2�������B��ʢ�ŵ�ҩƷ�� �� ������
��3��ʵ��ʱ������C�зų�Һ��IJ���������
��4��װ������ʢ�ŵ�����Ϊ �� ��ȱ��װ���ң���ʵ������ʲôӰ�죿
��5���Ȼ��ᣨClSO3H����һ����ɫ�ķ���Һ�壬�д̼��Գ�ζ���е�178�棬���ȷֽ�Ҳ���Ƶ������ȣ�ͬʱ��������һ���������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ �� �������ķ�����
A���ؽᾧ B������ C������ D����ȡ
��6��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������������ţ�
A.���������ٶȣ��������˿�
B.ˮԡ����������ƿ
C.��������ƿ���̣����ʵ����£�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com