
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:填空题
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)_________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
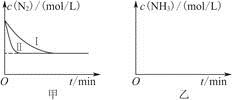
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学反应中能量变化的有关概念及计算(解析版) 题型:选择题
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是 
A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是
| X |
| Y |
|
|
|
| W |
|
|
|
|
|
|
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
已知33As、35Br位于同一周期,下列关系正确的是
A 原子半径:As>C1>P B 热稳定性:HC1>AsH3>HBr
C 还原性:As3->S2->C1- D 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及其应用(解析版) 题型:选择题
下列有关元素的性质及其递变规律正确的是
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及其应用(解析版) 题型:选择题
下列说法正确的是
A.第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱
B.L层电子数为奇数的所有元素都是非金属元素
C.ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强
D.同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学三类分散系及比较(解析版) 题型:选择题
下列有关分散系的说法正确的是
A.一种分散系中可以有一种分散质,也可以有多种分散质
B.浊液的分散质都能通过过滤从分散剂中分离出来
C.分散剂一定是液体
D.同一种溶质的饱和溶液要比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com