
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、③>①>④>② |
| B、③>①>②>④ |
| C、①>④>③>② |
| D、①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 mL 0.03 mol?L-1HCl溶液 |
| B、20 mL 0.02 mol?L-1KCl溶液 |
| C、30 mL 0.02 mol?L-1CaCl2溶液 |
| D、50 mL 0.05 mol?L-1AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在盐酸溶液中,AgCl的溶解度会减小 |
| B、向存在AgCl沉淀的少量溶液中加入NaI固体,会生成黄色沉淀 |
| C、向AgNO3溶液中加入足量盐酸,反应后的溶液中没有Ag+ |
| D、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 产生了乙烯 |
| D | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 出现红色沉淀 | 蔗糖水解已水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浊液a中存在着AgCl沉淀溶解平衡 |
| B、滤液b中不含有Ag+ |
| C、③中颜色变化说明AgCl转化为AgI |
| D、实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
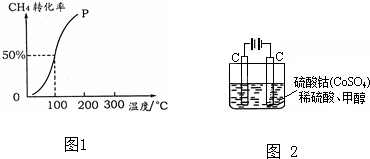
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com