
已知:还原性强弱:I— >Fe2+。往100 mL碘化亚铁
溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1 B.1.5mol·L-1 C.1.2mol·L-1 D.1.0mol·L-1
科目:高中化学 来源: 题型:
某化学小组欲探究铁及其化合物的氧化性和还原性。请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是______。
(2)请帮助他们完成以下实验报告:
一、实验目的:_______________________________________________________。
二、试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液。
三、实验记录(画斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=== Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+===3Fe2+ | Fe3+具有氧化性 | |
| ④ | Fe3+具有氧化性 |
四、实验结论:
Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有______。(填序号)
A.Cl2 B.Na C.Na+
D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化:_________________________________________________,
并简述Fe2+的检验方法:_________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中两种气体的分子数一定相等的是
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不等的CO和C2H4 D.压强相同、体积相同的O2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需用2 mol·L-1氯化钠溶液450 mL,配置时应选用
容量瓶的规格和称取氯化钠的质量分别是
A. 450 mL,52.7g B.500 mL,58.5g C.1000 mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
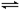 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
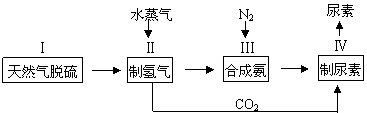 |
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)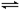 CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)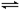 CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是 。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为 。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式
_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为H2N-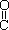 -NH2,请写出尿素的同分异构体中含有离子键的化学式 。
-NH2,请写出尿素的同分异构体中含有离子键的化学式 。
 (5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
(5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验的描述错误的一项是 ( )
A.取5mL 0.1 mol/L KI溶液,滴加0.1mol/LFeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+
B.在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀
C.燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多
D.蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水法收集
D.1.12 LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应(1)2Fe3++2I-===2Fe2++I2;(2)Br2+2Fe2+===2Br-+2Fe3+。可判断离子的还原性由强到弱的顺序正确的是( )
A.Br->Fe2+>I- B.I->Fe2+>Br-
C.Br->I->Fe2+ D.Fe2+>I->Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com