
【题目】下列说法正确的是 ( )
A. 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物
B. 酸性氧化物不一定是非金属氧化物
C. 金属氧化物一定是碱性氧化物
D. 纯净物只由一种原子组成,而混合物由多种原子组成
科目:高中化学 来源: 题型:
【题目】只用一种试剂鉴别正己烷、1-己烯、乙醇、苯酚水溶液4种无色液体,应选用
A. 酸性KMnO4溶液
B. 饱和溴水
C. NaOH溶液
D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定溶液种一定能大量共存的离子组是( )
A. pH=1的溶液中:NH4+、Na+、Fe3+、SO42-
B. 碱性溶液种:Na+、K+、HCO3-、NO3-
C. 中性溶液中:K+、Al3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物
D.CuSO4·5H2O是一种混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构和性质】A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q

(1)写出A的基态核外电子排布式 ;用最简式表示B、C形成合金的组成 (用B、C元素符号表示)。该合金的密度为 a g/cm3,其晶胞的边长为 。
(2)含有D、碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,一个电子是由硫原子所得,则其电子式为 。
(3)实验测得气态无水Q在1.Ol×105Pa、t1℃的密度为5.OO g·L-1、气体摩尔体积为53.4 L·mol-,则此时Q的组成为(写化学式) ;
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,则MgO 晶体中Mg2+的配位数是 ,KCl、MgO、CaO 的熔点由高到低为 。
(5)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因 。
共价键 | C—C | C—N | C—S |
键能/kJ·mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丙烯酸(C6H5-CH=CHCOOH)有多种同分异构体,其中含有苯环、—COO—、C=C,且苯环上有两个取代基的结构(不考虑顺反异构)有
A. 4种 B. 6种 C. 8种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下药品和装置:mg锌片、铁片、稀硫酸、水,设计一个实验,测定锌的相对原子质量(实验是在通常状况下进行的)。请完成下列实验:
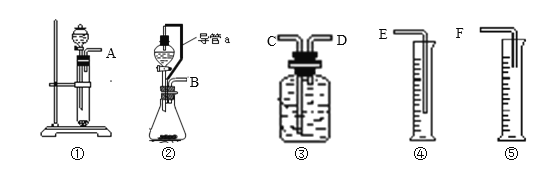
(1)写出该反应的化学方程式 。
(2)所选用装置的连接顺序为(填接口字母) 。
(3)取Wg纯铁片与稀硫酸反应测得生成气体V1mL,该步骤的目的是 。
(4)实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒④,使其中液面与广口瓶中液面相平
C.上下移动量筒⑤,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(5)mg锌片与稀硫酸反应测得生成气体V2mL,则Zn的相对原子质量的数学表达式为 (用上述字母表示)。
(6)假设锌片中含不与酸反应的杂质,实验测得锌的相对原子质量可能比真实值(填“偏大”、“偏小”或“不变”,下同) ;实验结束时,仰视量筒读数,测得值 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中含微粒数目最多的是
A.0.5molOH—中的电子 B.1mol H2中的H原子
C.0.6mol H2SO4中的O原子 D.1molNa完全反应后失去的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
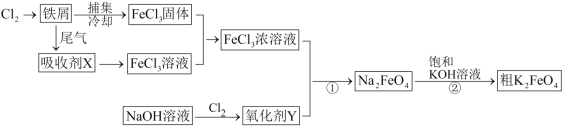
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com