
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
【答案】B
【解析】
石墨作电极电解500 mL KNO3和Cu(NO3)2的混合溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况)阳极产生氧气,阴极开始时生成铜,然后放出氢气,n(O2)= n(H2)=![]() =1mol,根据阳极反应式4OH--4e-═O2↑+2H2O可知,转移4mol电子,阴极反应式为Cu2++2e-═Cu、2H++2e-═H2↑,生成氢气转移2mol电子,则生成铜也转移2mol电子,即有1mol Cu2+放电。
=1mol,根据阳极反应式4OH--4e-═O2↑+2H2O可知,转移4mol电子,阴极反应式为Cu2++2e-═Cu、2H++2e-═H2↑,生成氢气转移2mol电子,则生成铜也转移2mol电子,即有1mol Cu2+放电。
A.根据以上分析,电解得到的Cu的物质的量为1mol,故A错误;
B.由以上分析可知,析出1molCu,1molH2和1molO2,根据少什么加什么,则加入98g即1mol的Cu(OH)2可恢复为原溶液,故B正确;
C.c(Cu2+)=![]() =2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故C错误;
=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故C错误;
D.电解后溶液中c(H+)为![]() =4mol/L,故D错误;
=4mol/L,故D错误;
故选B。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
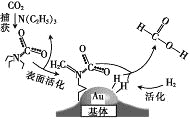
A. 标准状况下,22.4L CO2中所含的电子数目为16NA
B. 10.1g N(C2H5)3中所含的非极性共价键数目为0.3NA
C. 2mol Au与2mol H2中所含的分子数目均为2NA
D. 100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。下面几种有机化合物的转化关系:
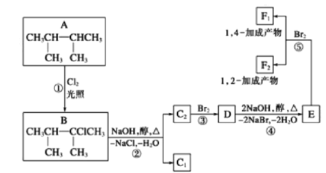
(1)根据系统命名法,化合物A的名称是_________
(2)写出物质D中所含官能团的名称_____________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式___________
(4)C2的结构简式是____________,F1的结构简式是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
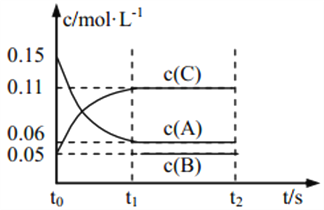
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
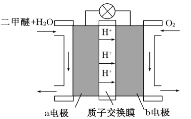
a电极是________极,其电极反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序
及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序
①过滤②加过量的NaOH溶液③加过量的盐酸④加过量的Na2CO3溶液⑤加过量的BaCl2溶液⑥加热蒸发
A.④①⑤②①③⑥B.⑤①④②③⑥C.②⑤④①③⑥D.①②⑤④①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com