
【题目】图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。
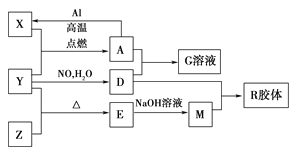
回答下列问题:
(1)组成单质Z的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是______________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为____________。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:_____________________________________________________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:__________________________________。
【答案】 第三周期第IVA族 离子键、共价键 H2SiO3(或H4SiO4)  8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8akJ·mol-1 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8akJ·mol-1 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
【解析】A俗称磁性氧化铁,即为四氧化三铁;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁;
(1)根据氧原子的核外电子排布,可知氧元素在周期表的第二周期第VIA族;硅酸钠中有离子键、共价键;R的化学式是H2SiO3(或H4SiO4);
(2)ZH4的分子式为SiH4,其电子式为:![]() ;
;
(3)根据热化学方程式的书写方法和书写原则,先写出铝和四氧化三铁反应的化学方程式,再注明状态和焓变;故该反应的热化学方程式为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8akJ/mol;
(4)四氧化三铁和硝酸反应是,铁元素均被氧化到最高价,硝酸中氮元素被还原到+2价,故发生反应的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O。


科目:高中化学 来源: 题型:
【题目】下列有关多电子原子的叙述中正确的是( )
A. 在一个多电子原子中,不可能有两个运动状态完全相同的电子
B. 在一个多电子原子中,不可能有两个能量相同的电子
C. 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
D. 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
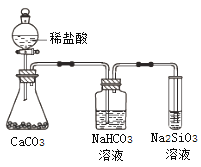
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。

(1)下列有关说法正确的是_____________。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是____________。
a.汽油 b.甲醇(CH3OH) c.甲醛(HCHO) d.乙酸(CH3COOH)
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H=﹣90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
CH3OH(g) △H=﹣90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO 、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
平衡常数 | K1 | K2 | K3 |
反应物转化率 | α 1 | α 2 | α 3 |

下列说法正确的是________________。
a.c1 = c2 b.2Q1 = Q3 c.K1 = K3 d.α2 + α3<100%
(4)某实验小组设计如图b所示的电池装置,正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol-1。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=________。
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_______________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 烧结粘土制陶瓷涉及化学变化
B. 焊接时用NH4Cl溶液除锈
C. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃器皿上刻蚀标记
D. 轮船船底四周镶嵌铜块以保护船体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s)ΔH>0下列叙述正确的是( )
Z(g)+W(s)ΔH>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.乙二醇可用于配制汽车防冻液
B.酶不属于蛋白质
C.在植物油中滴入溴水,溴水褪色
D.蔗糖水解生成的两种有机物互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com