
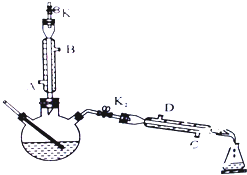
 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
| A、明矾和氯气均可用于水的消毒、杀菌 |
| B、地沟油不能食用,但可以在循环经济中发挥作用 |
| C、硬铝属于合金材料,餐桌上的瓷盘属于硅酸盐制品 |
| D、不需要通过化学反应就能从海水中获得食盐和淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只存在乙酸分子中 |
| B、存在于乙酸乙酯、乙醇中 |
| C、只存在于乙醇分子中 |
| D、只存在于水分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c (Mg2+)?c (CO32-)=6.82×10-6 |
| B、常温下,在0.10 mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,c( NH4+)/c(NH3?H2O)值变大 |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c (H2CO3) |
D、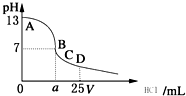 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. |
查看答案和解析>>
科目:高中化学 来源: 题型:
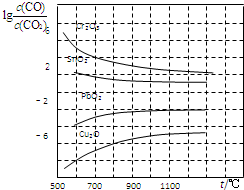 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.| 50-80℃ |
| 180-200℃ |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
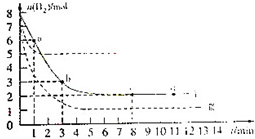 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.查看答案和解析>>
科目:高中化学 来源: 题型:
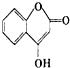 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: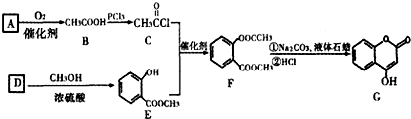
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com