
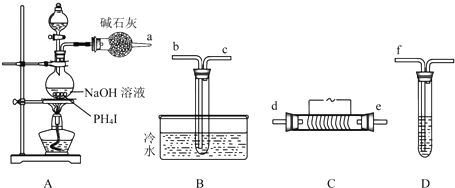
分析 制取磷化氢并验证其性质实验流程:乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2( S04)3反应),乙醚为易挥发的有机溶剂,实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚,并微热数分钟,目的是将空气排尽,以防止PH3在装置中燃烧(或自燃),提供惰性气体环境,再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热,发生反应PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O,在装置C处用电热器控制温度在300℃左右,发生反应:4PH3$\frac{\underline{\;300℃\;}}{\;}$P4+6H2(或2PH3$\frac{\underline{\;300℃\;}}{\;}$2P+3H2),B装置的试管中有白色蜡状固体生成为白磷,D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,说明生成+2价的铁,磷化氢具有还原性,发生反应:4PH3+12Fe3+=P4↓+12Fe2++12H+(或 PH3+3Fe3+=P↓+3Fe2++3H+),同时也有白色蜡状固体白磷生成.
(1)根据实验目的先排装置中的空气,防止反应物磷化氢、生成物白磷燃烧,然后,加入氢氧化钠,制取硫化氢,硫化氢分解,B观察反应的产物,最后检验铁离子和磷化氢的反应,据此连接装置;
(2)N与P处在同一主族,根据碘化氨合碱的反应书写反应方程式;
(3)乙醚为易挥发的有机溶剂,实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚,并微热数分钟,目的是将空气排尽;
(4)磷化氢受热分解生成白磷、氢气,磷化氢和铁离子发生氧化还原反应生成亚铁离子和白磷;
(5)装置B中磷化氢受热分解,说明磷化氢不稳定,装置C中磷化氢能将铁离子还原成亚铁离子,说明其具有还原性;
(6)磷化氢、氢气都能燃烧,可通过燃烧的方法进行尾气处理.
解答 解:制取磷化氢并验证其性质实验流程:乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2( S04)3反应),乙醚为易挥发的有机溶剂,实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚,并微热数分钟,目的是将空气排尽,以防止PH3在装置中燃烧(或自燃),提供惰性气体环境,再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热,发生反应PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O,在装置C处用电热器控制温度在300℃左右,发生反应:4PH3$\frac{\underline{\;300℃\;}}{\;}$P4+6H2(或2PH3$\frac{\underline{\;300℃\;}}{\;}$2P+3H2),B装置的试管中有白色蜡状固体生成为白磷,D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,说明生成+2价的铁,磷化氢具有还原性,发生反应:4PH3+12Fe3+=P4↓+12Fe2++12H+(或 PH3+3Fe3+=P↓+3Fe2++3H+),同时也有白色蜡状固体白磷生成.
(1)B装置的试管中有白色蜡状固体生成为白磷,连接顺序为a→d、e(或e、d),检验磷化氢的还原性,D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,说明生成+2价的铁,连接顺序为b、c→f,
故答案为:d、e、b、c (或 e、d、b、c);
(2)铵盐和碱反应生成氨气,N与P处在同一主族,磷盐和碱反应生成磷化氢,反应为PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O,
故答案为:PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O;
(3)PH3在空气中易燃烧(或自燃),装置中若空气不排尽,会自燃,所以实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是将空气排尽,以防止PH3在装置中燃烧(或自燃),
故答案为:将空气排尽,以防止PH3在装置中燃烧(或自燃);
(4)由上述分析可知,C中发生4PH3$\frac{\underline{\;300℃\;}}{\;}$P4+6H2,D中离子反应为4PH3+12Fe3+=P4↓+12Fe2++12H+,
故答案为:4PH3$\frac{\underline{\;300℃\;}}{\;}$P4+6H2;4PH3+12Fe3+=P4↓+12Fe2++12H+;
(5)B装置的试管中有白色蜡状固体生成为白磷,为磷化氢受热分解生成的产物,说明磷化氢不稳定,装置C中磷化氢能将铁离子还原成亚铁离子4PH3+12Fe3+=P4↓+12Fe2++12H+(或 PH3+3Fe3+=P↓+3Fe2++3H+),说明其具有还原性,
故答案为:BC;
(6)磷化氢有毒,需进行尾气处理,磷化氢、氢气都能燃烧,可通过燃烧的方法进行尾气处理,硫化氢与硫酸铜溶液能反应,
故答案为:将尾气点燃或通入到CuSO4溶液.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、实验装置的作用、习题中的信息为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com