
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
分析 0.1mol•L-1 NaHA的强电解质溶液中,c(H+)<c(OH-),则HA-的水解大于其电离,溶液显碱性,并结合电荷守恒式及物料守恒式来解答.
解答 解:A.因溶液不显电性,由电荷守恒可知c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),故A错误;
B.存在A的微粒有H2A、HA-、A2-,由物料守恒可知c(H2A)+c(HA-)+c(A2-)=0.1mol•L-1,故B正确;
C.因Kw=c(H+)•c(OH-),只与温度有关,则将上述溶液稀释至0.01mol/L,c(H+)•c(OH-)不变,故C正确;
D.由电荷守恒为c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),物料守恒式为c(H2A)+c(HA-)+c(A2-)=c(Na+),所以c(A2-)+c(OH-)=c(H+)+c(H2A),故D正确;
故选A.
点评 本题考查离子浓度大小的比较,明确NaHA的强电解质溶液中c(H+)<c(OH-)得到HA-的水解大于其电离是解答本题的关键,熟悉电荷守恒式及物料守恒式即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
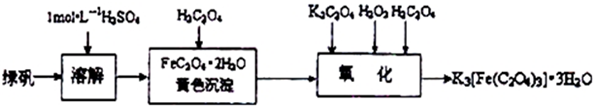
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
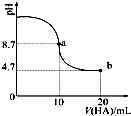 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
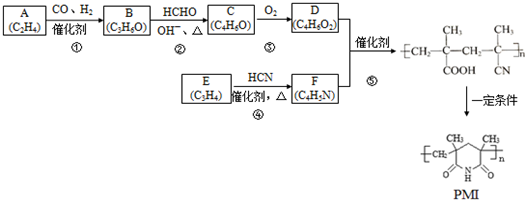
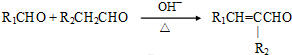 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)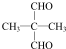 .
.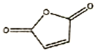 和
和 反应可制备
反应可制备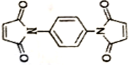 .然后以
.然后以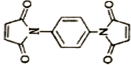 为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$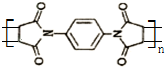 (X中无碳碳双键)
(X中无碳碳双键)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
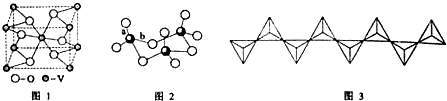
 .
.
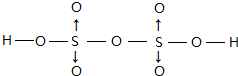 (配位键须注明).
(配位键须注明).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-3-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 1,2-二甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com