
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
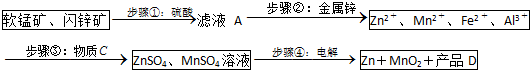
分析 (1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高;
(2)滤液A中含金属离子,加Zn发生置换反应;
(3)由转化可知,铁离子、铝离子转化为沉淀;
(4)步骤④中电解过程中MnO2应在阳极生成,因Mn元素失去电子,阴极上Zn得到电子,得到的硫酸可循环使用.
解答 解:(1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高,由电子、原子守恒可知,反应分别为MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O,
故答案为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O;MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)步骤②加入金属锌发生如下反应:Zn+CuSO4═ZnSO4+Cu,Zn+CdSO4═ZnSO4+Cd,Zn+2Fe3+═Zn2++2Fe2+,过滤得滤液B,其中的成分有MnSO4、Al2(SO4)3、ZnSO4、FeSO4,滤渣乙中有Cu、Cd,加以回收,
故答案为:Cu、Cd;
(3)由转化可知,铁离子、铝离子转化为沉淀,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+;另外一种固体物质可为Zn(OH)2(Mn(OH)2、ZnCO3、MnCO3等)促进铁离子水解转化为沉淀,
故答案为:将Fe2+氧化为Fe3+;Zn(OH)2;
(4)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:阳;Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;用于溶解软锰矿和闪锌矿,循环使用.
点评 本题考查混合物分离提纯的综合应用及物质制备实验,为高频考点,题目难度中等,明确简化流程中的反应原理、混合物分离方法为解答的关键,试题侧重分析与应用能力的考查.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
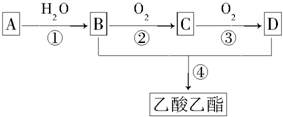
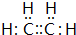 ;C的分子式是C2H4O.
;C的分子式是C2H4O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
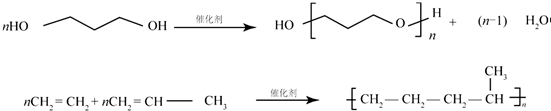
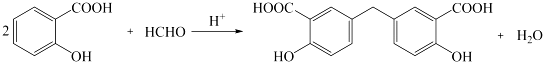 .
.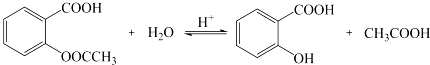 .
.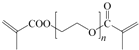 .
.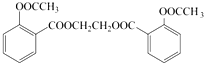 .
.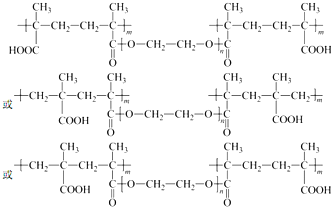 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
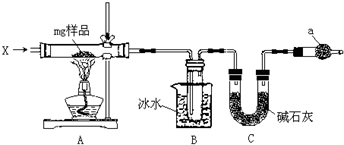
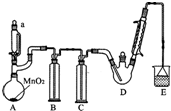 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
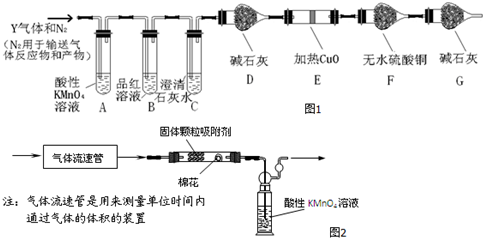
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是一种核素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2COOCH3是不同物质 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
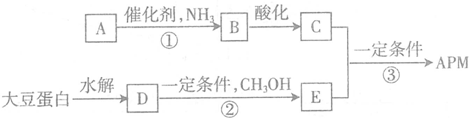
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
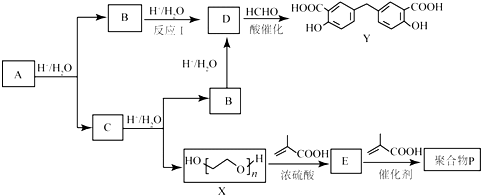
 .C中所含官能团的名称为羧基、氨基.
.C中所含官能团的名称为羧基、氨基. .
.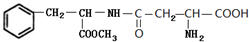 和
和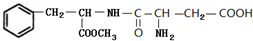 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com