
| A. | 取溶液进行焰色反应显黄色,一定含有Na+ | |
| B. | 滴加BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 滴加KSCN溶液,变为血红色,溶液中含Fe2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
分析 A.钠离子的焰色反应的火焰呈黄色;
B.能够与氯化钡反应生成的白色沉淀可能为碳酸钡、亚硫酸钡等,不一定为硫酸钡;
C.铁离子与硫氰根离子反应显示红色;
D.生成的气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子,不一定含有碳酸根离子.
解答 解:A.取溶液进行焰色反应显黄色,则溶液中一定含有Na+,故A正确;
B.滴加BaCl2溶液,产生白色沉淀,该沉淀可能为碳酸钡,不一定为硫酸钡,则溶液中不一定含有SO42-,故B错误;
C.滴加KSCN溶液,变为血红色,说明溶液中含Fe3+,故C错误;
D.加入稀盐酸产生无色气体,该气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子,不一定含有CO32-,故D错误;
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意检验离子存在情况时,需要排除干扰离子,确保检验方案的严密性,试题培养了学生的逻辑推理能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
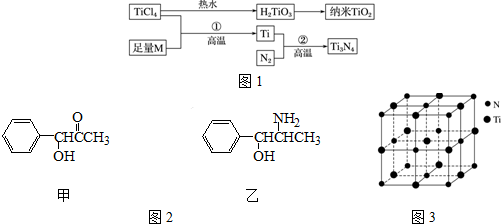
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
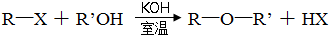 ,
,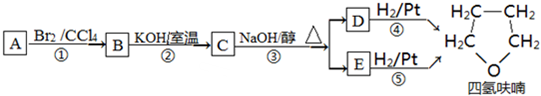
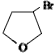 ,D
,D ,E
,E .
.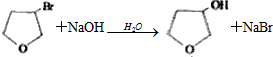 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
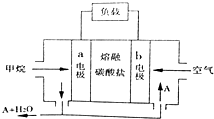
| A. | 正极的电极反应为:O2+2H2O+4e-=4OH- | |
| B. | 电池工作时,CO32-移向b电极 | |
| C. | 若实验过程中转移4mol电子,则该电池消耗11.2L CH4 | |
| D. | 为使电池稳定运行,电池的电解质组成应保持恒定.该电池工作时,应有物质A循环利用,A为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | a的取值范围 | 产物的化学式或(离子符号) |
| A | a≤$\frac{1}{6}$ | I2,Br- |
| B | $\frac{1}{6}$<a<$\frac{1}{5}$ | I2、Br-、Br2 |
| C | a=$\frac{1}{5}$ | I2、Br2 |
| D | $\frac{1}{5}$<a<$\frac{6}{5}$ | I2,IO3-,Br2 |
| E | a≥$\frac{6}{5}$ | IO3-、Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
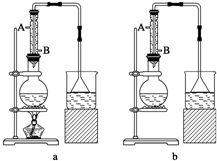
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| B. | 二氧化硫的水溶液能使紫色石蕊试液变红,说明它能与水反应生成H2SO3 | |
| C. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| D. | 将等体积的SO2和Cl2混和后通入滴有石蕊的水中,溶液的颜色将变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com