
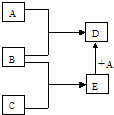
分析 A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4,据此分析解答.
解答 解:A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4,
(1)通过以上分析知,这五种物质的化学式为:A为Fe,B为O2,C为H2,D为Fe3O4,E为H2O,
故答案为:Fe;O2;H2;Fe3O4;H2O;
(2)在高温条件下,Fe和水蒸气反应生成四氧化三铁和氢气,所以A和E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断能力,以物质的状态、性质为突破口进行推断,注意:水蒸气和铁反应生成四氧化三铁和氢气而不是生成氢氧化铁和氢气,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 该反应既是置换反应又是氧化还原反应 | |
| B. | Zn作还原剂,H2SO4作氧化剂 | |
| C. | Zn被氧化,H2SO4被还原 | |
| D. | 发生氧化反应的物质是H2SO4,发生还原反应的物质是Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O分子的中心原子形成sp2杂化轨道 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O和0.1mol C6H2O6 | |
| D. | 0.1mol H2SO4和0.4NA个H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g NH3 | B. | 0.1mol NH4NO3 | C. | 6g NH4NO3 | D. | 13.2g (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

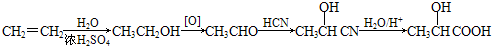
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com