
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。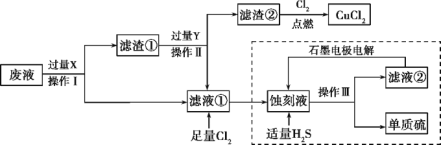
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
【答案】过滤 漏斗 KSCN溶液 2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu Fe+2HCl=FeCl2+H2↑ 2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+ 2Fe2+-2e-=2Fe3+ 硫化氢的原子利用率为100%
【解析】
根据流程图,滤液①中通入足量的氯气,能够生成蚀刻液(FeCl3),因此滤液①为FeCl2,则废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的X为铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,经过过滤得到滤渣①为铜与铁,滤液①为氯化亚铁溶液,滤渣①中加入过量的Y得到氯化亚铁溶液,因此Y为盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,过滤得到滤渣②为铜,铜与氯气反应生成氯化铜,滤液①通入足量氯气生成氯化铁,氯化铁与硫化氢反应生成硫单质和氯化亚铁,过滤得到单质硫和滤液②为氯化亚铁,电解可以生成氯化铁。据此分析解答。
(1)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ都是分离固体与液体的操作,应为过滤操作,用到的玻璃仪器主要有:烧杯、玻璃棒、漏斗,缺少的仪器为:漏斗,故答案为:过滤;漏斗;
(2)滤渣②与氯气反应得到氯化铜,则滤渣②为铜,氯化铁与铜反应生成氯化铁和氯化铜,所以刻蚀液主要为三氯化铁,检验三价铁离子,可以用KSCN溶液,如果加入KSCN溶液出现血红色,证明含有三价铁离子,故答案为:KSCN溶液;
(3)根据上述分析,X为铁,铁能够与溶液中三价铁离子,铜离子发生反应,离子方程式依次是:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu,故答案为:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu;
(4)滤渣①为铜和过量的铁,除去铁,应加入过量的盐酸,所以Y为盐酸,铜与盐酸不反应,铁与盐酸反应生成氯化亚铁,反应的化学方程式:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(5)刻蚀液为氯化铁,通入硫化氢发生氧化还原反应,反应的化学方程式为:,离子方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,故答案为:2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+;
(6)氯化铁与硫化氢反应生成硫单质和氯化亚铁、氯化氢,过滤得到滤渣为硫单质,滤液为氯化亚铁和盐酸,电解二者的混合物,阳极上Fe2+失去电子发生氧化反应生成Fe3+,电极反应式为:2Fe2+-2e-=2Fe3+,故答案为:2Fe2+-2e-=2Fe3+;
(7)依据氯化铁与硫化氢反应可知硫化氢在反应中原子利用率为100%,故答案为:硫化氢的原子利用率为100%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2018年6月1日,陨石坠落西双版纳,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:
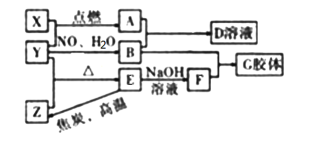
(1)关于E的说法正确的是___________________(填序号)
①E硬度大、熔点高、在自然界广泛存在
②E既能与NaOH溶液反应,又能与HF酸反应,其为两性物质
③可用盐酸除去E中混有少量X
④E是良好的半导体材料
(2)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析标明电子转移数目______________
(3)写出E与NaOH溶液反应的离子方程式:_________________________________
(4)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法_________
(5)F物质用氧化物的形式表示为:__________________。
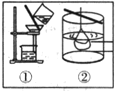
(6)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____________;净化G胶体可采用如图_____________(填序号)的方法,这种方法叫_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
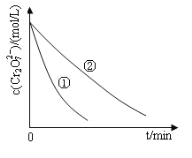
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:
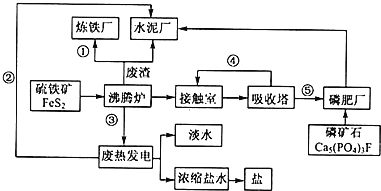
(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属在人类社会发展进程中发挥了重要作用,钠、镁、铝、铁、铜是最重要的几种金属。
(1)上述五种金属中人们发现并最早制得其单质的是_____________。
(2)这五种金属单质都具有的性质是_________________(填下列选项的序号)。
a.导电性 b.延展性 c.银白色 d.熔点高 e.硬度大
(3)钠、镁、铝、铁四种金属中,不能用于从氯化铜溶液中置换出铜的金属是_________,原因是 _________(用必要的化学方程式表示)。
(4)上述金属中,有一种金属的氧化物能在另一种金属的氢氧化物的水溶液中溶解,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。
回答下列问题:
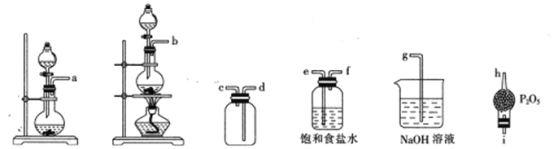
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制C12,Cu和稀HNO3制NO。
①制取NO的离子方程式为________________________
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为____(气流方向从左至右)。
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:
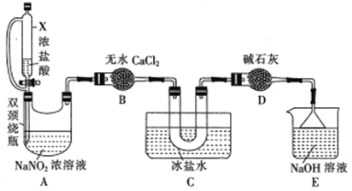
①仪器X的名称为_______,用它代替分液漏斗的优点是_________________
②装置C的U形管中观察到的现象是____________,装置D的作用是_________
(3)取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com