
【题目】下列物质:①纯碱②食盐水③空气④烧碱⑤液氯⑥硝酸钾,分类全正确的是( )
A.碱——①④B.电解质——③④⑤C.混合物——②③D.盐——②⑥
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,也是优质的燃料,工业上可由乙烯水合法或发酵法生产。回答下列问题:
(1)乙烯水合法可分为两步
第一步:反应CH2=CH2+ HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于反应_______________(填反应类型)。
②第二步反应的化学方程式为_____________________________。
(2)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇

纤维素的化学式为________,现要制取4.6 吨乙醇,至少需要植物秸秆________吨。
(3)乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。乙醇汽油中乙醇是可再生能源,来源于________(填“乙烯水合法”或“发酵法”)。
(4)以乙醇为原料可制备某种高分子涂料,其转化关系如下图:

①有机物A的结构简式为___________。
②反应Ⅱ的化学方程式为___________。
③反应Ⅱ的反应类型为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。进行皂化反应时的步骤如下:
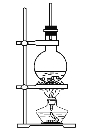
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水、10 mL酒精。加入酒精的作用为______________________;
加入NaOH溶液的作用是___________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成。证明皂化反应进行完全的方法是_______________________。
(3)皂化反应完成后,加入饱和NaCl溶液的作用是____________________。
(4)图中长玻璃导管的作用为________________________。
(5)写出该反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组对乙醇的分子结构进行探究,其过程如下:
猜想一:乙醇的结构简式是CH3CH2OH
猜想二:乙醇的结构简式是CH3OCH3
制定方案并实施:按下图所示实验装置进行实验,

测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:
(1)指出实验装置中的错误 。
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(4)如果实验装置正确,实验结果为2.3 g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56 L,则乙醇的结构简式应为 ,理由是 。
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的 (用序号填写)。
①装置的气密性良好;
②实验开始前准确测定乙醇的量;
③钠足量;
④广口瓶中水的体积大于560 mL;
⑤氢气的体积测算准确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
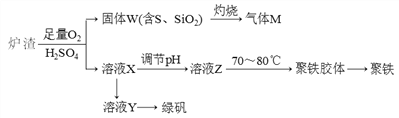
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃在标准状况下密度为2.59 g·L-1。
(1)其相对分子质量等于________。
(2)该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是________,分子式是________。
(3)可能的结构简式及名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
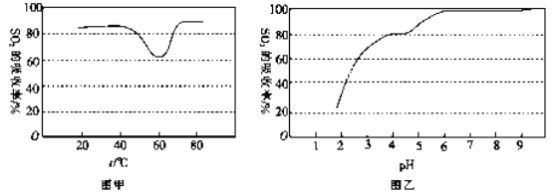
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
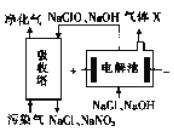
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的球棍模型为: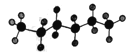 ,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
A. R能使溴的四氯化碳溶液褪色 B. R一定是2,2-二甲基丁烷
C. R不溶于水且密度比水大 D. R的一氯代物可能有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:

(1)酸式电池的电极反应:负极______________,正极________________;电池总反应:___________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极______________,正极_____________;电池总反应:________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com