
(8分)离子晶体X是由三种短周期元素组成,三种短周期元素的简单离子的核外电子排布相同,晶胞参数a=780pm,晶胞中阴离子组成立方最密堆积,阳离子(r=102pm)占据全部八面体和四面体空隙。
2-1 写出X的化学式 和化学名称 ;
2-2 指出阴离子的空间构型 ;
2-3 计算晶体X的密度;
2-4 X在化工生产中有什么用途;
2-5 另有一种晶体Y,其阴离子也组成立方最密堆积,且与X的阴离子互为等电子体,而阳离子与X的阳离子相同,但只占据全部四面体空隙,请写出Y的化学式。
科目:高中化学 来源: 题型:阅读理解
 ,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:
,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | A能分别与B、C、D形成电子总数相等的分子X、Y、Z |
| B | B基态原子的价电子结构为nsnnpn |
| C | D与B在同一周期,D原子核外未成对电子数等于电子层数 |
| D | E的最高价氧化物的水化物是酸性最强的含氧酸 |


| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
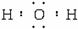
请回答下列问题:
(1)实现上图的转化,若X为金属单质,在甲、乙、丙三种晶体中,一定不是离子晶体的物质是_____________。
(2)若X、Y、Z三种元素的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,一个乙分子中含有的Y原子个数比一个甲分子中含有的Y原子个数多一个,写出甲分子的电子式___________________,写出乙在一定的条件下反应生成丙的化学方程式_________________。
(3)若X、Y、Z为短周期元素,Y、Z同主族,且Z的质子数大于Y,甲、丙的摩尔质量相等;写出甲与水反应的化学方程式________________________,写出丙溶于水的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省成都市高三“三诊”模拟考试(理综)化学部分 题型:填空题
(16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似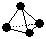 ,已知断裂1 mol B—B吸收167
kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167
kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O _________________________。
_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com