
【题目】在体积不变的绝热密闭容器中,一定量SO2与1molO2在催化剂作用下发生反应:![]() △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
△H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
A. 再通入1molO2,平衡正向移动,平衡常数不变
B. 降低温度,正反应速率先减小后增大
C. 平衡时SO2气体的转化率为50%
D. 该条件下反应放出0.5QkJ的热量
【答案】D
【解析】依据反应前后气体物质的量变化可知反应前后气体物质的量减小为反应的氧气物质的量;结合化学反应三段式列式计算,设二氧化硫起始量为x;
2SO2(g)+O2(g) ![]() 2SO3(g)+QkJ
2SO3(g)+QkJ
起始量(mol) x 1 0
变化量(mol)1 0.5 1
平衡量(mol) x-1 0.5 1
A、增大反应物浓度,平衡正向进行,在体积不变的绝热密闭容器中,温度升高,所以平衡常数一定发生改变,故A错误;B、降低温度反应速率减小,正逆反应速率减小,反应是放热反应,平衡正向移动,正向反应速率减小的少,故B错误;C、平衡时SO2气体的转化率为:![]() ×100%=50%,只有x=2时正确,故C错误;D、依据反应放热,1mol氧气反应放热QKJ,反应了0.5mol氧气,放热0.5QkJ,故D正确;故选D。
×100%=50%,只有x=2时正确,故C错误;D、依据反应放热,1mol氧气反应放热QKJ,反应了0.5mol氧气,放热0.5QkJ,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】纤维素等生物碳源材料可以高产率制备石墨烯(如图),下列说法正确的是( )

A. 石墨烯导电属于化学变化
B. 石墨烯与金刚石结构相同
C. 纤维素与淀粉互为同分异构体
D. 纤维素属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体扮末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验。请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中发生反应的离子方程式为_____________________。氧化剂与还原剂的物质的量之比为_________________。
(2)虚线框内的实验装置图中所加试剂为_______,说明装置的作用_________。
(3)装置B中盛放的试剂是_______(选填下列所给试剂的代码)。实验现象为________,离子方程式是___________,该反应属于四种基本反应类型中的_______反应。
A. Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。写出该反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙炔分子中的化学键描述不正确的是
A. 两个碳原子采用sp杂化方式 B. 两个碳原子采用sp2杂化方式
C. 每个碳原子都有两个未杂化的2p轨道形成π键 D. 两个碳原子形成两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJmol-1
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJmol-1
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1
D. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(8x-2y)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
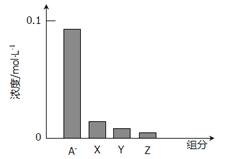
A. A可能表示Na+ B. A可能表示乙酸分子
C. 若图中A表示CH3COO-,可以证明乙酸是弱酸 D. 该混合溶液中:c(A)+c(Y)=c(X)+c(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )

A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在足量NaI溶液中,加入少量氯水及四氯化碳,振荡后静置,出现的现象( )
A.溶液不分层,溶液呈紫红色
B.溶液分两层,上层液体呈紫红色
C.溶液分两层,下层液体呈紫红色
D.溶液分两层,下层是无色液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com