
(15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。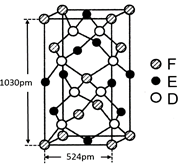
⑴M 9个 ⑵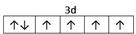 1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
⑶ sp2 ; 四面体 ;⑷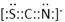 ; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
⑹CuFeS2 ; 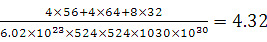
解析试题分析:根据题意可得A是C;B是N;C是O;D是S;E是Fe;F是Cu。⑴基态S原子核外电子排布是1s22s22p63s23p4,可见电子占据的最高能层是M层;在M能层有1个s轨道、3个p轨道、5个d轨道,一共具有的原子轨道数是9个。⑵Fe2+离子的价层电子排布图是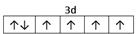 ;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为
;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为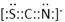 。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2 ;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2 ;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: g/cm3。
g/cm3。
考点:考查元素的推断、原子的价电子排布图、原子的电子排布式、离子的电子式、检验、晶体的化学式的确定及晶体密度的计算的知识。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:填空题
(6分)下表是元素周期表的一部分,请回答有关问题: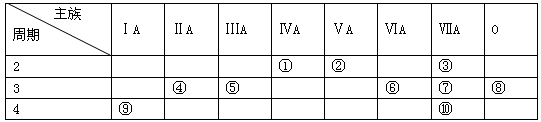
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学—--选修3:物质结构与性质】(15分)
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为 ;
(2)Mn基态原子核外处在能量最高的能级上的电子共有 种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为 ;
② HCHO分子中C原子轨道的杂化类型为 ;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是
g(保留两位小数);阿伏加德罗常数为 (列式计算,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2 X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) 类推法是科学学习的重要方法之一
⑴下列类推结论正确的是
| | 类比对象 | 结论 |
| A | Cl2+H2O HCl+HClO HCl+HClO | I2+H2O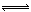 HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: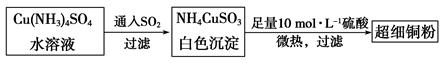
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②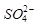 的空间构型为_____________,
的空间构型为_____________,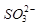 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 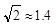 ,列式并计算结果)。
,列式并计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH =-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: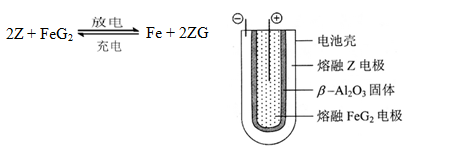
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com