
分析 由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,以此解答该题.
解答 解:(1)由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,则此原电池的装置图为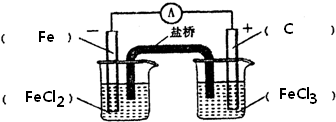 ,
,
故答案为: ;
;
(2)负极为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-=Fe2+,正极为活泼性比铁弱的金属或非金属,可为碳棒,发生还原反应,Fe3+被还原生成Fe2+,电极方程式为2Fe3++2e-=2Fe2+,
答:负极:Fe-2e-=Fe2+;正极:2Fe3++2e-=2Fe2+.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.


科目:高中化学 来源: 题型:选择题
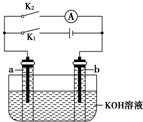 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据实验装置和下述操作,回答下列有关问题:
根据实验装置和下述操作,回答下列有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com