
| A. | 混合溶液中由水电离出来的c(OH-)=1×10-9mol/L | |
| B. | c(OH-)-c(HY)=c(H+)=1×10-5mol/L | |
| C. | 混合溶液中c(Na+)=c(Y-)+c(HY)=0.15mol/L | |
| D. | 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
分析 取0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合,恰好生成NaY,测得混合溶液的pH=9,说明溶液呈碱性,NaY为强碱弱酸盐、c(OH-)>c(H+)、c(Na+)>c(Y-),然后结合盐类水解原理以及物料守恒解答该题.
解答 解:取0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合,恰好生成NaY,测得混合溶液的pH=9,说明溶液呈碱性,NaY为强碱弱酸盐,
A.NaY为强碱弱酸盐,水解呈碱性,水解促进水的电离Y-,混合溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,故A错误;
B.根据物料守恒,应有c(HY)+c(Y-)=c(Na+),根据电荷守恒应有c(Na+)+c(H+)=c(Y-)+c(OH-),二者联式可得:c(HY)+c(H+)=c(OH-),则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1,故B错误;
C.0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,从物料守恒的角度分析,溶液中应存在c(Na+)=c(Y-)+c(HY)=0.15mol•L-1,故C正确;
D.溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),溶液中离子浓度由大到小的顺序为:c(Na+)>c(Y-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断以及离子浓度大小比较问题,题目难度中等,注意根据题中信息判断盐类水解的特点,结合守恒思想解答该题,试题培养了学生的分析能力及灵活应用能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:填空题
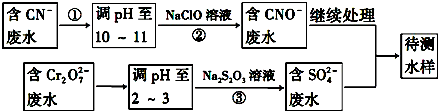
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的种类很多,它们都能溶解于水 | |
| B. | 蛋白质水解的最终产物是氨基酸 | |
| C. | 蛋白质溶液中加入浓盐酸,颜色变黄 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质将变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 平衡时A的浓度为1.50mol/L | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在NaHS溶液中滴入少量的CuCl2溶液产生黑色沉淀,HS-电离程度增大,反应后溶液pH减小 | |
| B. | 浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 | |
| C. | 在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
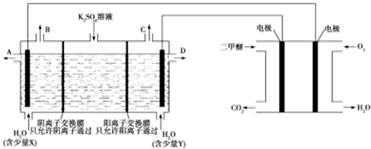
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
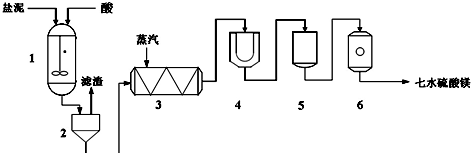
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
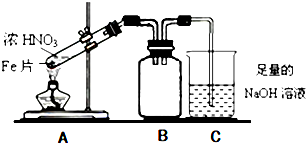
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com