
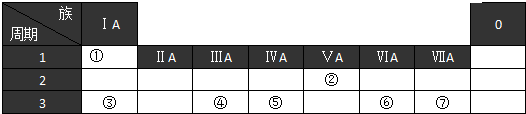
分析 根据元素在周期表中的位置知,①-⑦分别是H、N、Na、Al、Si、S、Cl元素;
(1)该元素的硅元素;
(2)同一周期元素,原子半径随着原子序数增大而减小;同一主族元素,原子半径随着原子序数增大而增大,所以原子电子层数越多其原子半径越大;
(3)元素②氢化物是氨气、其最高价氧化物的水化物是硝酸,氨气和硝酸反应生成硝酸铵;
(4)③和④的最高价氧化物的水化物分别是NaOH、氢氧化铝,二者反应生成偏铝酸钠和水;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:根据元素在周期表中的位置知,①-⑦分别是H、N、Na、Al、Si、S、Cl元素;
(1)该元素的硅元素,元素符号为Si,故答案为:Si;
(2)同一周期元素,原子半径随着原子序数增大而减小;同一主族元素,原子半径随着原子序数增大而增大,所以原子电子层数越多其原子半径越大,所以原子半径最小的位于周期表左上角、原子半径最大的位于周期表左下角,则原子半径最小的是H、最大的是Na,故答案为:H;Na;
(3)元素②氢化物是氨气、其最高价氧化物的水化物是硝酸,氨气和硝酸反应生成硝酸铵,离子方程式为NH3+H+=NH4+,故答案为:NH3+H+=NH4+;
(4)③和④的最高价氧化物的水化物分别是NaOH、氢氧化铝,二者反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S,则其最高价氧化物的水化物酸性HClO4>H2SO4,故答案为:HClO4>H2SO4.
点评 本题考查元素周期表和元素周期律的综合运用,为高频考点,明确原子结构、元素周期表结构、元素周期律内涵是解本题关键,注意氢氧化铝的两性,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙试液显红色的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42- | |
| C. | 由水电离出来的c(H+)=1×10-13 mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{K_w}{{c({H^+})}}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置
为了探究实验室制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸的酯化反应不属于取代反应 | |
| B. | 煤的干馏是物理变化 | |
| C. | 戊烷的同分异构体有三种 | |
| D. | 蛋白质、淀粉、油脂均属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Na+)=c (HB-)+2 c (B2-)+c (H2B) | B. | c(Na+)=0.01 mol/L≥c (B2-) | ||
| C. | c (H+)•c (OH-)=10-14 | D. | c (Na+)+c (H+)=c(HB-)+c (B2-)+c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com