
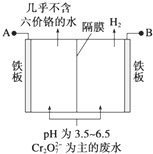
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )| A、A电源的负极 |
| B、阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液的pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L时有0.1molCr2O72-被还原 |
| V |
| Vm |
| 13.44L |
| 22.4L/mol |
| 0.6mol×2 |
| 2 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①④⑥ |
| C、③④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加稀硝酸酸化,再加入Ba(NO3)2溶液 |
| B、加BaCl2溶液即可 |
| C、先加盐酸酸化,再加BaCl2溶液 |
| D、加Ba(NO3)2溶液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
| A、①②③ | B、①③⑤ |
| C、①③⑥ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:| G 实验分组 | 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:F2>C12>Br2 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、热稳定性:SiH4>PH3>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com