
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):
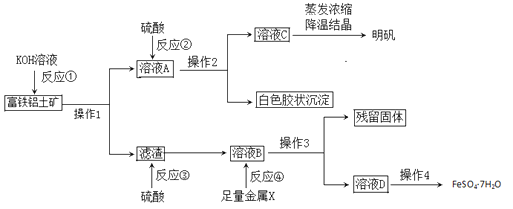
(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
【答案】 过滤 ④ Fe Fe+2Fe3+=3Fe2+ SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O Fe2+ 取少量溶液D于试管中,滴入硫氰化钾溶液,无现象;再滴入几滴氯水,若变红;证明含有Fe2+ 47.4
【解析】本题考查化学工艺流程,涉及实验基本操作、化学反应类型、离子方程式的书写和化学计算,(1)操作I得到溶液和滤渣,因此操作I为过滤;(2)反应①中加入NaOH溶液,根据成分只有Al2O2和SiO2与NaOH反应,发生Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O,不属于氧化还原反应,反应②中加入硫酸,发生的SiO32-+2H+=H2SiO3↓,AlO2-+4H+=Al3++2H2O,没有化合价的改变,不属于氧化还原反应,反应③发生Fe2O3+6H+=2Fe3++3H2O,FeO+2H+=Fe2++H2O,没有化合价的改变,不属于氧化还原反应,根据操作4得到FeSO4·7H2O,说明反应④中加入一种金属,把Fe3+转化成Fe2+,即这种金属是铁单质,离子方程式为Fe+2Fe3+=3Fe2+,存在化合价的变化,属于氧化还原反应;(3)操作4得到FeSO4·7H2O,不能引入新杂质,因此此金属为Fe,离子方程式为:Fe+2Fe3+=3Fe2+;(4)根据(1)的分析,离子方程式为Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O;(5)根据(3)的分析,溶液D中含有的金属阳离子是Fe2+,利用Fe2+的还原性,具体操作是取少量溶液D于试管中,滴入硫氰化钾溶液,无现象;再滴入几滴氯水,若变红;证明含有Fe2+;(6)根据铝元素守恒,明矾的质量有10×106×27%×10-6×474/27t=47.4t。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mL B. 336mL C. 224mL D. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、 酒精灯、玻璃棒、量筒、蒸发皿、锥形瓶、牛角管、火柴。不能进行的实验操作是( )
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题:
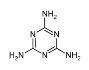
(1)基态Ca原子的电子排布式:___________________;CaC2的电子式________________。
(2)尿素分子中所含除氢以外元素第一电离能由小到大的顺序为________________。
(3)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22-的空间构型为________。
(4)三聚氰胺分子中碳原子的杂化方式为________,分子中处于同一平面的氮原子有_____个。
(5)动物摄入三聚氰胺和三聚氰酸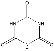 后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
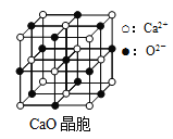
(6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________,已知CaO晶体的密度为ρ,用NA表示阿伏伽德罗常数,求晶胞中距离最近的两个钙离子之间的距离__________(用含ρ、NA代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物(NOx)、悬浮颗粒物等三种大气污染物的浓度。
(1)①与氮氧化物有关的全球或区域性大气环境问题有______________(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d. 温室效应
②悬浮颗粒物可用高压电除尘,是利用了 现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将尾气中的一氧化碳和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为 。
(3)①写出实验室中由固体物质制取氨气的化学方程式 ;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)
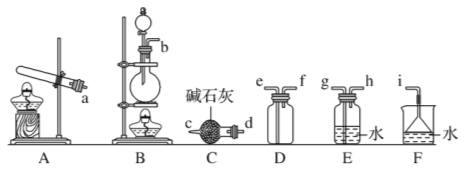
③实验室也可用下图所示装置制取氨气。烧瓶内固体可选用____________(选填选项的代号)。
a.碱石灰 b.生石灰 c.二氧化硅 d.五氧化二磷
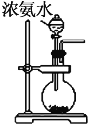
④催化剂存在下,NH3也可用来消除NOx的污染,生成两种对环境无害的物质,请写出NH3与NO2反应的化学方程式为 ,该反应中每生成0.5molN2转移 mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com