
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
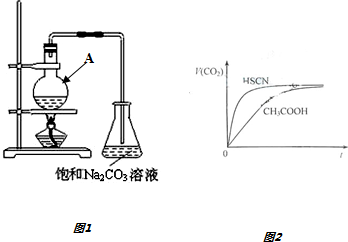
分析 (1)根据仪器的特点确定名称;浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)该反应生成乙酸乙酯和水,且为可逆反应,欲提高乙酸的转化率,应改变条件使平衡正向进行分析,两种反应物增大一种量灰提高另一种的转化率,减少生成物浓度促进平衡正向进行;
(4)根据表中数据分析温度转化率的影响,选择最佳的温度和反应时间;
(5)由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
(6)根据醋酸的电离平衡移动的影响因素来回答判断即可,若加入的物质影响醋酸离子的浓度,同时还会引起氢离子的浓度变化,则说明存在电离平衡,醋酸是弱酸.
解答 解:(1)仪器A的名称是圆底烧瓶,为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:圆底烧瓶;先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
(3)CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O反应是可逆反应,欲提高乙酸的转化率可以增加乙醇的量,平衡正向进行,乙酸转化率增大,也可以分离出乙酸乙酯,促进平衡正向进行,增大乙酸的转化率等,
故答案为:乙醇过量、及时分离出乙酸乙酯等;
(4)由表格中的同一反应时间来看,60℃时反应的转化率已经较高,且选择性为100%,同一温度时反应时间选择4小时转化率较高,
故选C;
(5)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(6)在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH?CH3COO-+H+的电离平衡.(注意:用CH3COONH4晶体而不是用CH3COONa晶体,是因为CH3COONH4在溶液中呈中性,故选择之).
答:在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在电离平衡,醋酸是弱酸.
点评 本题考查了乙酸乙酯的制备方法、可逆反应特点,题目难度中等,注意掌握乙酸乙酯的反应原理及制备方法,明确可逆反应特点,浓硫酸、饱和碳酸钠溶液、长导管在酯化反应中的作用为考查的热点,要求学生熟练掌握.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| X | Y |
| Z |
| A. | 气态氢化物的沸点:X<Y<Z | |
| B. | 最高正化合价:Y>X | |
| C. | X、Y、Z的最高价氧化物对应水化物中,Z的酸性最强 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的直径在1~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | Fe(OH)3胶体带正电荷,可以产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 | B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2 | ||
| C. | HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3 | D. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com