
分析 (1)由生成氢气的质量和铁合金的质量,根据铁与稀硫酸反应的化学方程式可以计算出铁合金中铁的质量和生成硫酸亚铁的质量;铁合金的质量与铁的质量之差就是铁合金中碳的质量,碳的质量与铁合金的质量之比就是铁合金的含碳量.通过比较就可以知道是生铁还是钢.
(2)由铁的质量加上稀硫酸的质量去掉生成氢气的质量,就是所得溶液的质量;硫酸亚铁的质量与所得溶液的质量之比就是所得溶液中溶质的质量分数.
解答 解:设铁合金中铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.3g
则:$\frac{56}{x}$=$\frac{152}{y}$=$\frac{2}{0.3g}$,
解得:x=8.4g、y=22.8g,
(1)铁合金的含碳量为:$\frac{8.5g-8.4g}{8.5g}$×100%≈1.2%<2%,故该铁合金属于钢,
答:通过计算可知该合金是钢;
(2)反应后溶液中溶质的质量分数为:$\frac{22.8g}{8.4g+91.9g-0.3g}$×100%=22.8%,
答:反应后所得溶液中溶质的质量分数是22.8%.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量分数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
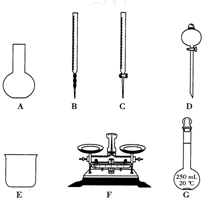 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=2的HA溶液与pH=12的BOH溶液等体积混合后,溶液的pH<7,则BA为强酸弱碱盐 | |
| B. | 弱电解质溶液稀释后,溶液中各离子浓度一定都减小 | |
| C. | 常温下,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 常温下,将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,氨水的碱性强于NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
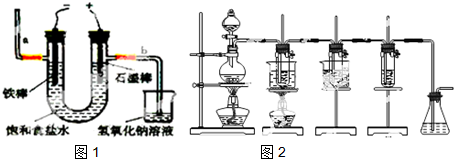
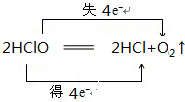 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LO2中含有的共键数为0.4NA | |
| B. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数0.2NA | |
| C. | 100g质量分数为16.2%HBr溶液中的氢原子数为NA | |
| D. | 3.9gNa2O2晶体中所含的离子总数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com