

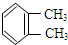
 与
与 是同一物质;
是同一物质;| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
分析 ①如果苯是单双键交替的结构,则含有的额碳碳双键能被高锰酸钾氧化;
②苯能和氢气加成恰好能说明苯是不饱和的结构;
③如果苯是单双键交替的结构,则邻二甲苯应有两种结构;
④根据碳碳双键的性质判断.
解答 解:①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故①正确;
②与氢气加成是苯和双键都有的性质,因此苯能在一定条件下跟H2加成生成环己烷,不能证明苯环中存在单双键交替结构,故②错误;
③如果是单双键交替结构,邻二甲苯的结构有两种,一种是两个甲基夹C-C,另一种是两个甲基夹C=C.邻二甲苯只有一种结构,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故③正确;
④苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故④正确.
所以①③④可以作为苯分子中不存在单、双键交替排列结构的证据.
故选B.
点评 本题考查苯的结构与性质,难度不大,综合性较大,要求学生知识掌握全面,能运用知识分析和解决问题,重在能力的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 43L | B. | 49L | C. | 50L | D. | 53L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛的分子式为CH3CHO | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr 的沸点依次升高 | |
| B. | O、S、Na、K 的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF 的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2 的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com