
| A. | 铝粉与氧化铁的反应 | B. | 炽热的炭与二氧化碳的反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 氢氧化钠与盐酸反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A.铝粉与氧化铁的反应属于铝热反应,为放热反应;
B.炽热的炭与二氧化碳的反应属于吸热反应;
C.锌片与稀硫酸的反应属于放热反应;
D.氢氧化钠与盐酸的反应属于放热反应;
所以能量变化与其他三项不相同的是B.
故选B.
点评 本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的烷烃,彼此都是同系物 | |
| B. | 两种化合物的组成元素相同,各元素的质量分数也相同,二者一定具有相同最简式 | |
| C. | 组成元素的质量分数相同的不同化合物互为同分异构体 | |
| D. | 互为同系物的有机物相对分子质量一定相差14的整数倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
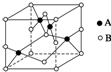 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
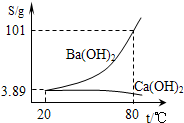 实验室有一份混有碳酸钙杂质的碳酸钡样品.分离并提纯碳酸钡的实验步骤如下,请根据要求填空(如图为Ba(OH)2和Ca(OH)2的溶解度曲线):
实验室有一份混有碳酸钙杂质的碳酸钡样品.分离并提纯碳酸钡的实验步骤如下,请根据要求填空(如图为Ba(OH)2和Ca(OH)2的溶解度曲线):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com