
【题目】判断下列离子方程式是否正确,错误的指明原因,并写出正确的离子方程式。____。
(1)铁粉溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
(3)氢氧化铜溶于盐酸:OH-+H+=H2O
(4)氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓
(5)铝与氯化铜溶液发生置换反应:Al+Cu2+=Al3++Cu
(6)硫酸溶液与氢氧化钡溶液混合:H++OH-+SO42-+Ba2+=BaSO4↓+H2O
(7)碳酸钙溶于硝酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合HCO3-+OH-=CO32-+H2O
【答案】
序号 | 正误 | 错误原因 | 正确的离子方程式 |
1 | × | 不符合反应的客观事实 | Fe+2H+═Fe2++H2↑ |
2 | × | 生成Fe(OH)3胶体,不是沉淀 | Fe3++3H2O |
3 | × | Cu(OH)2难溶,写化学式 | Cu(OH)2+2H+=2H2O+Cu2+ |
4 | × | 生成BaSO4和Cu(OH)2两种沉淀 | 2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓ |
5 | × | 原方程式两边电荷不守恒 | 2Al+3Cu2+=2Al3++3Cu |
6 | × | 生成BaSO4和H2O比例应为1:2 | 2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O |
7 | √ | ||
8 | × | Ca2+参加反应生成CaCO3沉淀 | Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32- |
【解析】
(1)铁粉溶于稀硫酸中生成硫酸亚铁和氢气,离子方程式为:Fe+2H+═Fe2++H2↑,故(1)错误;原因:不符合反应的客观事实;
故答案为:错误;不符合反应的客观事实;Fe+2H+═Fe2++H2↑;
(2)用三氯化铁溶液制取Fe(OH)3胶体,生成Fe(OH)3胶体,不是沉淀:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;故(2)错误;原因:生成Fe(OH)3胶体,不是沉淀,故答案为:错误;生成Fe(OH)3胶体,不是沉淀;Fe3++3H2O
Fe(OH)3(胶体)+3H+;故(2)错误;原因:生成Fe(OH)3胶体,不是沉淀,故答案为:错误;生成Fe(OH)3胶体,不是沉淀;Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(3)氢氧化铜溶于盐酸生成氯化铜和水:Cu(OH)2+2H+=2H2O+Cu2+,故(3)错误,原因:Cu(OH)2难溶,写化学式;故答案为:错误;Cu(OH)2难溶,写化学式;Cu(OH)2+2H+=2H2O+Cu2+;
(4)氢氧化钡溶液与硫酸铜溶液混合生成硫酸钡沉淀和氢氧化铜沉淀:2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓,故(4)错误;原因:生成BaSO4和Cu(OH)2两种沉淀;故答案为:错误;生成BaSO4和Cu(OH)2两种沉淀;2OH-+Cu2++SO42-+Ba2+=BaSO4↓+Cu(OH)2↓;
(5)铝与氯化铜溶液发生置换反应生成氯化铝和铜:2Al+3Cu2+=2Al3++3Cu,故(5)错误;原因为:原方程式两边电荷不守恒,故答案为:错误;原方程式两边电荷不守恒;2Al+3Cu2+=2Al3++3Cu;
(6)硫酸溶液与氢氧化钡溶液混合生成BaSO4和H2O:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故(6)错误,原因是:生成BaSO4和H2O比例为1:2;故答案为:错误,生成BaSO4和H2O比例为1:2;2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O;
(7)碳酸钙与硝酸反应生成硝酸钙和二氧化碳和水,离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,故(7)正确;
故答案为:正确;
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合生成碳酸钙沉淀和水,Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3,离子方程式: Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32-,故(8)错误;原因为:Ca2+参加反应生成CaCO3沉淀;故答案为:错误;Ca2+参加反应生成CaCO3沉淀;Ca2+ + 2HCO3- +2OH- =CaCO3↓+ 2H2O+CO32-。


科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
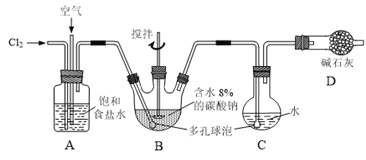
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1L1mol/L食盐水中。下列说法正确的是( )
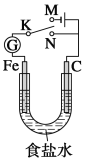
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28L(标准状况)气体时,生成了1.25molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
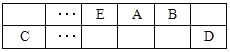
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a____b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:_______________填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:________________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________。
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________。
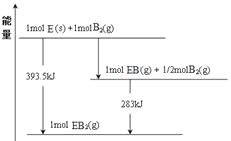
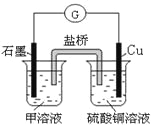
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
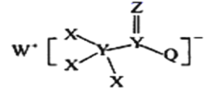
A.WX是共价化合物
B.最高价氧化物对应的水化物的酸性:Q<Y
C.原子半径:W>Z>Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。回答下列问题:
(1)丙烯与HCl加成生成CH3CHClCH3或CH3CH2CH2Cl的能量与反应历程如图:
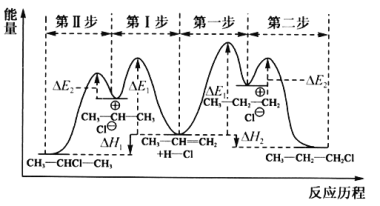
①从能量角度看,较稳定的产物是________(填“CH3CHClCH3”或“CH3CH2CH2Cl”)。
②制取CH3CHClCH3时,反应速率较慢的步骤是________(填“Ⅰ”或“Ⅱ”)。
(2)丙烷直接脱氢制丙烯的相关热化学反应如下:
主反应:C3H8(g)→C3H6(g)+H2 ΔH1=+124.27kJ·mol-1
副反应:C3H8(g)→CH4(g)+C2H4(g) ΔH2=+81.30kJ·mol-1
C3H8(g)+H2(g)→CH4(g)+C2H6(g) ΔH3=-55.64kJ·mol-1
C2H4(g)+H2(g)→C2H6(g) ΔH4
①ΔH4=_____________kJ·mol-1
②分别在0.1Mpa和0.01Mpa时,丙烷和丙烯的平衡物质的量分数如图所示:
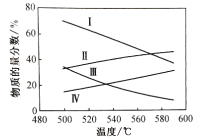
表示0.1Mpa时丙烷物质的量分数的是________(填罗马数字,下同);表示0.01Mpa时丙烯物质量的分数的是________。
(3)用二氧化碳氧化丙烷制丙烯主要反应如下:
Ⅰ.C3H8(g)![]() C3H6(g)+ H2 ΔH1>0平衡常数K1
C3H6(g)+ H2 ΔH1>0平衡常数K1
Ⅱ.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2>0平衡常数K2
CO(g)+H2O(g) ΔH2>0平衡常数K2
Ⅲ.耦合反应C3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(g)
C3H6(g)+CO(g)+H2O(g)
当C3H8的物质的量一定时,按不同投料比Z[Z=![]() ]向密闭容器中充入C3H8和CO2,发生反应Ⅲ,C3H8平衡转化率随温度变化如图所示:
]向密闭容器中充入C3H8和CO2,发生反应Ⅲ,C3H8平衡转化率随温度变化如图所示:
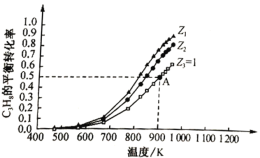
①反应Ⅲ的平衡常数K=________(用K1、K2表示)。
②Z1________(填“>”“<”“=”)Z2。原因是________
③若A点气体总压强为0.2Mpa,则丙烯的平衡分压为________MPa;900K时反应Ⅲ的平衡常数Kp=________MPa(Kp为用平衡分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关于反应H2(g)+![]() O2(g)===H2O(l),下列说法正确的是________(填字母)。
O2(g)===H2O(l),下列说法正确的是________(填字母)。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.该反应在常温下不易被观察,因为具有较高的活化能,反应速率小
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)电渗析法淡化海水装置示意图如图所示,在电场中利用膜技术可以实现淡化海水和浓缩海水的分离。

①图中膜a应选用________(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为________(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:______。
(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为____。
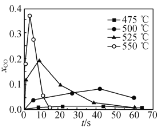
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO=![]() ,t为反应时间。 CO的分布分数先增后降的原因是___。
,t为反应时间。 CO的分布分数先增后降的原因是___。

③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com