
| Fe3+ | Ni2+ | Cr3+ | |
| ��ʼ���� | 1.5 | 6.7 | 4.0 |
| ������ȫ | 3.4 | 9.5 | 6.9 |
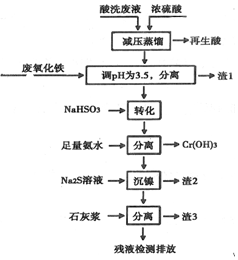
���� ��ϴ��Һ�к���Fe3+��Ni2+��NO3-��F-��+6�۸��ĺ���������ӵȣ�����Ũ�����ѹ�����������ֽ⣬�õ������ᣬ����Һ�м����������������ҺPH=3.5��ʹ������ȫ�����������˵õ���������Һ�м���NaHSO3��Cr2O72-������Ӧ�ղظ����ӣ�����������ˮ�����������γ������������������˺����Һ�м���Na2S�����������˵õ���Һ�м���ʯ�ҽ������õ�����3CaF2��Ca��OH��2��CaSO4���Դ˽����⣮
��� �⣺��1�������Ậ��HNO3��HF����ȡ��ѹ�����ԭ���ǽ���������¶��Լ�������ķֽ⣬
�ʴ�Ϊ������������¶��Լ�������ķֽ⣻
��2��������ҺPH=3.5��ʹ������ȫ��������������ΪFe��OH��3��
�ʴ�Ϊ��Fe��OH��3��
��3��ת��ʱNaHSO3��Cr2O72-����������ԭ����Ӧ���ɸ����ӡ���������Ӻ�ˮ����Ӧ�����ӷ���ʽΪ��Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O���ɷ���ʽ��֪��Ӧ���������뻹ԭ�������ʵ���֮��1��3���ʴ�Ϊ��1��3��
��4��Ni2+��������ˮ�ķ�ӦΪ��Ni2++6NH3?[Ni��NH3��6]2+������Na2S�����ɸ����ܵ�NiS���������������ӷ���ʽΪ��[Ni��NH3��6]2++S2-=NiS��+6NH3��
�ʴ�Ϊ��[Ni��NH3��6]2++S2-=NiS��+6NH3��
��5��������֪����3Ϊ���ɵ�CaF2����������ˮ���������ƺ�����ƣ�����3����Ҫ�ɷ�ΪCaF2��Ca��OH��2��CaSO4��
�ʴ�Ϊ��CaF2��
��6�������ܶȻ���������F-����Ũ�ȣ�Ksp=c��Ca2+��c��F-��2=4��10-11 mol3•L-3����Һ��c��Ca2+��=1.0��10��3mol•L-1����c��F-��=$\sqrt{\frac{4��1{0}^{-11}}{0.001}}$=2��10-4mol/L��
2��10-4mol/L��19g/mol=38��10-4g/L=3.8mg/L�����ݹ����ŷű�Ҫ�������Ũ��С��10mg•L-1�����жϣ����Ϲ��ұ���
�ʴ�Ϊ��3.8�����ϣ�
���� �����ۺϿ��������ʵķ�����ᴿ�Լ�ʵ���������������Ӧ�ã�Ϊ�߿��������ͣ����ؿ���ѧ���ķ���������ʵ�������ͼ���������ע��������ӷ��뷽�����������жϣ���Ŀ�Ѷ��еȣ�


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ʵ����
Ϊ��̽��AgNO3�������Ժ����ȶ���,ij��ѧ��ȤС�����������ʵ�顣
��.AgNO3��������
����������˿����AgNO3��Һ��,һ��ʱ�����˿ȡ����Ϊ������Һ��Fe����������,����Һ�е�Ag+������,����������ʵ�顣��ѡ�õ��Լ�:KSCN��Һ��K3[Fe(CN)6]��Һ����ˮ��
��1��������±�:
���� | ���� | ���� |
ȡ��������Ag+�����Һ���Թ���,����KSCN��Һ,�� | �� | ����Fe3+ |
ȡ��������Ag+�����Һ���Թ���,����� ,�� | �� | ����Fe2+ |
��ʵ����ۡ�Fe����������ΪFe2+��Fe3+
��.AgNO3�����ȶ���
����ͼ��ʾ��ʵ��װ��A����AgNO3����,��������ɫ����,��װ��D���ռ�����ɫ���塣����Ӧ������,�Թ��в�������Ϊ��ɫ��
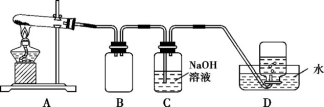

��2��װ��B�������� ��
��3����С�����۲���֤����ɫ����ΪO2,����֤������ ��
��4�����������ϡ�Ag2O�ͷ�ĩ״������Ϊ��ɫ;Ag2O�����ڰ�ˮ��
��������롿�Թ��в����ĺ�ɫ���������: ��.Ag; ��.Ag2O; ��.Ag��Ag2O��
��ʵ����֤����С��Ϊ��֤��������,�ֱ�ȡ������ɫ��������Թ���,����������ʵ�顣
ʵ���� | ���� | ���� |
a | ����������ˮ,�� | ��ɫ���岻�ܽ� |
b | ��������ϡ����,�� | ��ɫ�����ܽ�,����������� |
��ʵ�����ۡ���������ʵ��,����ȷ���������ɷֵ�ʵ���� (��ʵ����)��
��ʵ����ۡ���������ʵ����,д����С��ó�AgNO3�����ȷֽ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ������Ũ�ȵĹ�ϵ���㣺c��H+��=c��OH-��+c��CH3COO-�� | |
| B�� | 10mL0.01mol•L-1��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c��OH-����С | |
| C�� | �������Һ�м�������CH3COONa���壬ƽ�������ƶ� | |
| D�� | ������pH=2��CH3COOH��Һ��pH=12��NaOH��Һ�������Ϻ���Һ��pH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ࡢ��֬�������ʵ�ˮ����ﶼ�Ƿǵ���� | |
| B�� | ���ۺ���ά�صķ���ʽ��Ϊ��C6H10O5��n������Ϊͬ���칹�� | |
| C�� | ��ά�ء����ͷֱ���Ũ�������ʱ��Ũ����ķ�Ӧ����ͬһ���͵ķ�Ӧ | |
| D�� | �Ҵ�������ͱ��ӵķ����о����й�����-OH�����Ծ�����NaOH��Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������4��ͬ���칹�壬���ǵ��۵㡢�е������ͬ | |
| B�� | ��һ�������£�����Һ�塢Ũ���ᡢŨ�������������屽����������������ķ�Ӧ������ȡ����Ӧ | |
| C�� | ��������Ͷ�뵽ʢ��ˮ���Ҵ����ձ��У��Ƚ�ˮ���Ҵ�����Ļ����� | |
| D�� | �ۺ���  ���ɵ���CH3CH=CH2��CH2=CH2�Ӿ��Ƶ� ���ɵ���CH3CH=CH2��CH2=CH2�Ӿ��Ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8�� | B�� | 7�� | C�� | 6�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��ѧʽ | ������ʼʱ��pH | ������ȫʱ��pH | �й����� |
| Co��OH��2 | 7.2 | 9.4 | Co+2HCl�TCoCl2+H2�� Co2++2NH3•H2O�TCo��OH��2��+2NH4+ Co2++2H2O?Co��OH��2+2H+ Ni+2HCl�TNiCl2+H2�� Ni2++6NH3•H2O�TNi��NH3��6]2++6H2O |
| Fe��OH��2 | 7.1 | 9.6 | |
| Fe��OH��3 | 2.3 | 3.7 | |
| Mg��OH��2 | 10.8 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com