
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A、4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L?min) | ||
| B、此温度下该反应的平衡常数K=1.44 | ||
C、达平衡后,升高温度,
| ||
| D、若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变 |
| △c |
| △t |
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| △c |
| △t |
| (1.100-1.075)mol |
| 10L×(6-4)min |
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.122 |
| 0.1×0.1 |


科目:高中化学 来源: 题型:

| ||
| △ |

 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学在研究元素周期表中前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中不正确的是( )
某同学在研究元素周期表中前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中不正确的是( )| A、离O点越远的元素,其原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B元素是图中金属性最强的元素 |
| D、由元素A、B组成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 |
| B、甲烧杯中的酸过量 |
| C、两烧杯中生成氢气的速率相等 |
| D、反应开始后乙烧杯中c(H+)始终比甲烧杯中c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 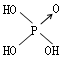 | 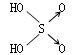 | 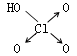 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中所含溶质的离子浓度大小关系为:c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加KCl溶液,黄色沉淀可能转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光化学烟雾的形成 |
| B、酸雨加剧 |
| C、臭氧空洞扩大 |
| D、温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com