
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
分析 A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.金属性越强,金属与水反应越剧烈;
C.熔点高低:原子晶体>离子晶体>分子晶体,相对分子质量越大,分子间作用力越强,分子晶体的熔点越高;
D.非金属性越强,氢化物还原性越弱.
解答 解:A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+>H+,故A错误;
B.金属性K>Ca>Na>Mg,金属性越强,金属与水反应越剧烈,故B错误;
C.CO2、SO3属于分子晶体,SO3对分子质量越大,分子间作用力越强,熔点较高,而SiO2属于原子晶体,Na2O属于离子晶体,故熔点:SiO2>Na2O>SO3>CO2,故C错误,
D.非金属性F>Cl>S>P,非金属性越强,氢化物还原性越弱,故还原性:PH3>H2S>HCl>HF,故D正确,
故选:D.
点评 本题考查微粒半径比较、元素周期律、晶体类型与性质等,明确比较规律即可解答,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化 | |
| B. | 溶液中四种离子之间有可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,则溶液中溶质一定是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
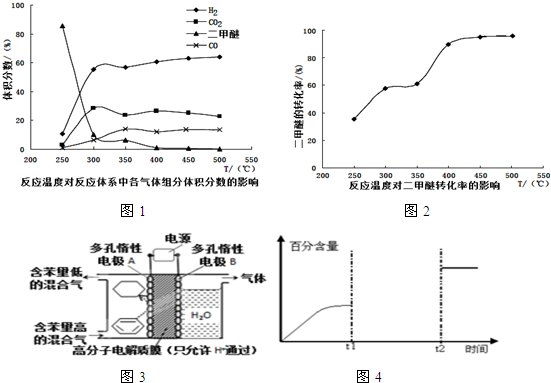
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
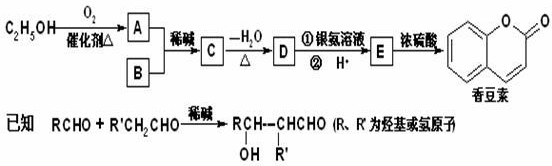
 ;
; ;
;  ;
;  ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
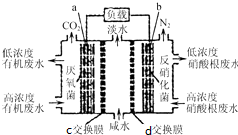 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )| A. | 电子从a极经负载到b极 | |
| B. | c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化 | |
| C. | 负极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com